+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | PRC2_AJ1-450 bound to H3K36me3 with histone H3 tail engaged | |||||||||
 マップデータ マップデータ | ||||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | complex / methyltransferase / histone / epigenetics / GENE REGULATION / GENE REGULATION-DNA complex | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報protein localization to pericentric heterochromatin / hepatocyte homeostasis / cellular response to trichostatin A / regulation of gliogenesis / negative regulation of striated muscle cell differentiation / regulation of kidney development / [histone H3]-lysine27 N-trimethyltransferase / response to tetrachloromethane / CAF-1 complex / negative regulation of keratinocyte differentiation ...protein localization to pericentric heterochromatin / hepatocyte homeostasis / cellular response to trichostatin A / regulation of gliogenesis / negative regulation of striated muscle cell differentiation / regulation of kidney development / [histone H3]-lysine27 N-trimethyltransferase / response to tetrachloromethane / CAF-1 complex / negative regulation of keratinocyte differentiation / histone H3K27 trimethyltransferase activity / negative regulation of retinoic acid receptor signaling pathway / cerebellar cortex development / primary miRNA binding / random inactivation of X chromosome / regulatory ncRNA-mediated heterochromatin formation / regulation of adaxial/abaxial pattern formation / skeletal muscle satellite cell maintenance involved in skeletal muscle regeneration / histone H3K27 methyltransferase activity / negative regulation of cardiac muscle cell proliferation / sex chromatin / ubiquitin-modified histone reader activity / negative regulation of cardiac muscle hypertrophy / positive regulation of cell cycle G1/S phase transition / facultative heterochromatin formation / NuRD complex / NURF complex / regulation of cell fate specification / negative regulation of stem cell population maintenance / genomic imprinting / DNA replication-dependent chromatin assembly / ESC/E(Z) complex / Transcription of E2F targets under negative control by p107 (RBL1) and p130 (RBL2) in complex with HDAC1 / regulation of stem cell differentiation / RSC-type complex / negative regulation of stem cell differentiation / protein-lysine N-methyltransferase activity / Polo-like kinase mediated events / cardiac muscle hypertrophy in response to stress / chromatin silencing complex / pronucleus / Transcription of E2F targets under negative control by DREAM complex / G1 to G0 transition / positive regulation of dendrite development / cardiac muscle cell proliferation / histone H3 methyltransferase activity / DNA methylation-dependent constitutive heterochromatin formation / histone methyltransferase activity / lncRNA binding / negative regulation of G1/S transition of mitotic cell cycle / ATPase complex / spinal cord development / negative regulation of gene expression, epigenetic / synaptic transmission, GABAergic / Sin3-type complex / G1/S-Specific Transcription / positive regulation of stem cell population maintenance / histone methyltransferase complex / Transcriptional Regulation by E2F6 / oligodendrocyte differentiation / negative regulation of transcription elongation by RNA polymerase II / RNA Polymerase I Transcription Initiation / histone deacetylase complex / G0 and Early G1 / negative regulation of cell differentiation / positive regulation of protein serine/threonine kinase activity / subtelomeric heterochromatin formation / : / ribonucleoprotein complex binding / pericentric heterochromatin / Transcriptional regulation of brown and beige adipocyte differentiation by EBF2 / Cyclin E associated events during G1/S transition / positive regulation of epithelial to mesenchymal transition / RNA polymerase II core promoter sequence-specific DNA binding / Chromatin modifying enzymes / positive regulation of MAP kinase activity / Cyclin A:Cdk2-associated events at S phase entry / nucleosome binding / keratinocyte differentiation / spleen development / protein localization to chromatin / Regulation of TP53 Activity through Acetylation / positive regulation of GTPase activity / Deposition of new CENPA-containing nucleosomes at the centromere / telomere organization / negative regulation of cytokine production involved in inflammatory response / Interleukin-7 signaling / RNA Polymerase I Promoter Opening / Assembly of the ORC complex at the origin of replication / B cell differentiation / Regulation of endogenous retroelements by the Human Silencing Hub (HUSH) complex / SUMOylation of chromatin organization proteins / liver regeneration / DNA methylation / negative regulation of cell migration / Condensation of Prophase Chromosomes / liver development / Chromatin modifications during the maternal to zygotic transition (MZT) / HCMV Late Events / thymus development 類似検索 - 分子機能 | |||||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.1 Å | |||||||||
 データ登録者 データ登録者 | Cookis T / Nogales E | |||||||||
| 資金援助 |  米国, 2件 米国, 2件
| |||||||||
 引用 引用 |  ジャーナル: Nat Struct Mol Biol / 年: 2025 ジャーナル: Nat Struct Mol Biol / 年: 2025タイトル: Structural basis for the inhibition of PRC2 by active transcription histone posttranslational modifications. 著者: Trinity Cookis / Alexandria Lydecker / Paul Sauer / Vignesh Kasinath / Eva Nogales /  要旨: Polycomb repressive complex 2 (PRC2) trimethylates histone H3 on K27 (H3K27me3) leading to gene silencing that is essential for embryonic development and maintenance of cell identity. PRC2 is ...Polycomb repressive complex 2 (PRC2) trimethylates histone H3 on K27 (H3K27me3) leading to gene silencing that is essential for embryonic development and maintenance of cell identity. PRC2 is regulated by protein cofactors and their crosstalk with histone modifications. Trimethylated histone H3 on K4 (H3K4me3) and K36 (H3K36me3) localize to sites of active transcription and inhibit PRC2 activity through unknown mechanisms. Using cryo-electron microscopy, we reveal that histone H3 tails containing H3K36me3 engage poorly with PRC2 and preclude its effective interaction with chromatin, while H3K4me3 binds to the allosteric site in the EED subunit, acting as an antagonist that competes with activators required for spreading of the H3K27me3 repressive mark. Thus, the location of the H3K4me3 and H3K36me3 modifications along the H3 tail allows them to target two requirements for efficient trimethylation of H3K27 by PRC2. We further show that the JARID2 cofactor modulates PRC2 activity in the presence of these histone modifications. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_43361.map.gz emd_43361.map.gz | 108.1 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-43361-v30.xml emd-43361-v30.xml emd-43361.xml emd-43361.xml | 27 KB 27 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  emd_43361.png emd_43361.png | 20.3 KB | ||
| Filedesc metadata |  emd-43361.cif.gz emd-43361.cif.gz | 8.5 KB | ||
| その他 |  emd_43361_half_map_1.map.gz emd_43361_half_map_1.map.gz emd_43361_half_map_2.map.gz emd_43361_half_map_2.map.gz | 200.4 MB 200.4 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-43361 http://ftp.pdbj.org/pub/emdb/structures/EMD-43361 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-43361 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-43361 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_43361_validation.pdf.gz emd_43361_validation.pdf.gz | 1.1 MB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_43361_full_validation.pdf.gz emd_43361_full_validation.pdf.gz | 1.1 MB | 表示 | |
| XML形式データ |  emd_43361_validation.xml.gz emd_43361_validation.xml.gz | 15.6 KB | 表示 | |
| CIF形式データ |  emd_43361_validation.cif.gz emd_43361_validation.cif.gz | 18.4 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-43361 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-43361 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-43361 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-43361 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  8vnvMC  8vmiC  8vmjC  8vmlC  8vmnC  8vnzC  8vo0C  8vobC M: このマップから作成された原子モデル C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_43361.map.gz / 形式: CCP4 / 大きさ: 216 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_43361.map.gz / 形式: CCP4 / 大きさ: 216 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.05 Å | ||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-ハーフマップ: #1
| ファイル | emd_43361_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
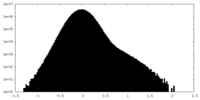
| 密度ヒストグラム |
-ハーフマップ: #2
| ファイル | emd_43361_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
+全体 : PRC2_AJ1-450 bound to H3K36me3 modified nucleosome with tail engaged
+超分子 #1: PRC2_AJ1-450 bound to H3K36me3 modified nucleosome with tail engaged
+分子 #1: Polycomb protein SUZ12
+分子 #2: EED
+分子 #3: RBAP48
+分子 #4: Isoform 2 of Histone-lysine N-methyltransferase EZH2
+分子 #5: Protein Jumonji
+分子 #6: Zinc finger protein AEBP2
+分子 #8: H3K36me3-modified histone H3
+分子 #7: DNA (26-mer)
+分子 #9: DNA (26-MER)
+分子 #10: S-ADENOSYL-L-HOMOCYSTEINE
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 緩衝液 | pH: 7.9 |
|---|---|
| 凍結 | 凍結剤: ETHANE |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | TFS KRIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: GATAN K3 BIOQUANTUM (6k x 4k) 平均電子線量: 50.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / 最大 デフォーカス(公称値): 1.8 µm / 最小 デフォーカス(公称値): 0.8 µm |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
- 画像解析
画像解析
| 初期モデル | モデルのタイプ: EMDB MAP EMDB ID: |
|---|---|
| 最終 再構成 | 解像度のタイプ: BY AUTHOR / 解像度: 3.1 Å / 解像度の算出法: FSC 0.143 CUT-OFF / 使用した粒子像数: 61193 |
| 初期 角度割当 | タイプ: MAXIMUM LIKELIHOOD |
| 最終 角度割当 | タイプ: MAXIMUM LIKELIHOOD |
 ムービー
ムービー コントローラー
コントローラー



































 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)