+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 8wh9 | ||||||
|---|---|---|---|---|---|---|---|
| タイトル | Structure of DDM1-nucleosome complex in ADP-BeFx state | ||||||
 要素 要素 |
| ||||||
 キーワード キーワード |  GENE REGULATION (遺伝子発現の調節) / GENE REGULATION (遺伝子発現の調節) /  complex / complex /  nucleosome (ヌクレオソーム) / nucleosome (ヌクレオソーム) /  chromatin remodeling (クロマチンリモデリング) / chromatin remodeling (クロマチンリモデリング) /  structural protein-hydrolase-dna complex (構造) structural protein-hydrolase-dna complex (構造) | ||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報DNA-mediated transformation /  トランスポゾン / chloroplast thylakoid / chromocenter / response to water deprivation / トランスポゾン / chloroplast thylakoid / chromocenter / response to water deprivation /  原形質連絡 / plant-type vacuole / DNA methylation-dependent heterochromatin formation / 原形質連絡 / plant-type vacuole / DNA methylation-dependent heterochromatin formation /  チラコイド / ATP-dependent chromatin remodeler activity ...DNA-mediated transformation / チラコイド / ATP-dependent chromatin remodeler activity ...DNA-mediated transformation /  トランスポゾン / chloroplast thylakoid / chromocenter / response to water deprivation / トランスポゾン / chloroplast thylakoid / chromocenter / response to water deprivation /  原形質連絡 / plant-type vacuole / DNA methylation-dependent heterochromatin formation / 原形質連絡 / plant-type vacuole / DNA methylation-dependent heterochromatin formation /  チラコイド / ATP-dependent chromatin remodeler activity / チラコイド / ATP-dependent chromatin remodeler activity /  色素体 / 色素体 /  葉緑体 / heterochromatin formation / epigenetic regulation of gene expression / 葉緑体 / heterochromatin formation / epigenetic regulation of gene expression /  DNA helicase activity / DNA helicase activity /  葉緑体 / response to bacterium / response to wounding / 葉緑体 / response to bacterium / response to wounding /  ペルオキシソーム / structural constituent of chromatin / ペルオキシソーム / structural constituent of chromatin /  ヌクレオソーム / ヌクレオソーム /  ヘリカーゼ / ヘリカーゼ /  クロマチンリモデリング / protein heterodimerization activity / クロマチンリモデリング / protein heterodimerization activity /  核小体 / 核小体 /  ATP hydrolysis activity / ATP hydrolysis activity /  DNA binding / extracellular region / DNA binding / extracellular region /  ATP binding / ATP binding /  細胞核 / 細胞核 /  細胞膜 / 細胞膜 /  細胞質基質 細胞質基質類似検索 - 分子機能 | ||||||
| 生物種 |   Arabidopsis thaliana (シロイヌナズナ) Arabidopsis thaliana (シロイヌナズナ)synthetic construct (人工物) | ||||||
| 手法 |  電子顕微鏡法 / 電子顕微鏡法 /  単粒子再構成法 / 単粒子再構成法 /  クライオ電子顕微鏡法 / 解像度: 3.31 Å クライオ電子顕微鏡法 / 解像度: 3.31 Å | ||||||
 データ登録者 データ登録者 | Liu, Y. / Zhang, Z. / Du, J. | ||||||
| 資金援助 |  中国, 1件 中国, 1件
| ||||||
 引用 引用 |  ジャーナル: Nat Plants / 年: 2024 ジャーナル: Nat Plants / 年: 2024タイトル: Molecular basis of chromatin remodelling by DDM1 involved in plant DNA methylation. 著者: Yue Liu / Zhihui Zhang / Hongmiao Hu / Wei Chen / Fan Zhang / Qian Wang / Changshi Wang / Kaige Yan / Jiamu Du /   要旨: Eukaryotic gene regulation occurs at the chromatin level, which requires changing the chromatin structure by a group of ATP-dependent DNA translocases-namely, the chromatin remodellers. In plants, ...Eukaryotic gene regulation occurs at the chromatin level, which requires changing the chromatin structure by a group of ATP-dependent DNA translocases-namely, the chromatin remodellers. In plants, chromatin remodellers function in various biological processes and possess both conserved and plant-specific components. DECREASE IN DNA METHYLATION 1 (DDM1) is a plant chromatin remodeller that plays a key role in the maintenance DNA methylation. Here we determined the structures of Arabidopsis DDM1 in complex with nucleosome in ADP-BeF-bound, ADP-bound and nucleotide-free conformations. We show that DDM1 specifically recognizes the H4 tail and nucleosomal DNA. The conformational differences between ADP-BeF-bound, ADP-bound and nucleotide-free DDM1 suggest a chromatin remodelling cycle coupled to ATP binding, hydrolysis and ADP release. This, in turn, triggers conformational changes in the DDM1-bound nucleosomal DNA, which alters the nucleosome structure and promotes DNA sliding. Together, our data reveal the molecular basis of chromatin remodelling by DDM1. | ||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  8wh9.cif.gz 8wh9.cif.gz | 367.1 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb8wh9.ent.gz pdb8wh9.ent.gz | 275.7 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  8wh9.json.gz 8wh9.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/wh/8wh9 https://data.pdbj.org/pub/pdb/validation_reports/wh/8wh9 ftp://data.pdbj.org/pub/pdb/validation_reports/wh/8wh9 ftp://data.pdbj.org/pub/pdb/validation_reports/wh/8wh9 | HTTPS FTP |
|---|
-関連構造データ
| 関連構造データ | 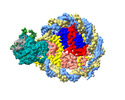 37535MC  8wh5C  8wh8C  8whaC  8whbC M: このデータのモデリングに利用したマップデータ C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
|
|---|---|
| 1 |
|
- 要素
要素
-タンパク質 , 5種, 9分子 AEBFCGDHK
| #1: タンパク質 |  ヒストンH3 ヒストンH3分子量: 15300.968 Da / 分子数: 2 / 由来タイプ: 組換発現 由来: (組換発現)   Arabidopsis thaliana (シロイヌナズナ) Arabidopsis thaliana (シロイヌナズナ)遺伝子: HTR2, At1g09200, T12M4.9, HTR3, At3g27360, K1G2.8, HTR13, At5g10390, F12B17_260, HTR9, At5g10400, F12B17_250, HTR1, At5g65360, MNA5.9 発現宿主:   Escherichia coli BL21 (大腸菌) / 参照: UniProt: P59226 Escherichia coli BL21 (大腸菌) / 参照: UniProt: P59226#2: タンパク質 |  ヒストンH4 ヒストンH4分子量: 11436.467 Da / 分子数: 2 / 由来タイプ: 組換発現 由来: (組換発現)   Arabidopsis thaliana (シロイヌナズナ) Arabidopsis thaliana (シロイヌナズナ)遺伝子: At1g07660, F24B9.25, At1g07820, F24B9.8, At2g28740, F8N16.2, T11P11.4, At3g45930, F16L2_140, At3g46320, F18L15.40, At3g53730, F5K20_30, At5g59690, MTH12.10, At5g59970, MMN10.22 発現宿主:   Escherichia coli BL21 (大腸菌) / 参照: UniProt: P59259 Escherichia coli BL21 (大腸菌) / 参照: UniProt: P59259#3: タンパク質 | 分子量: 13680.854 Da / 分子数: 2 / 由来タイプ: 組換発現 由来: (組換発現)   Arabidopsis thaliana (シロイヌナズナ) Arabidopsis thaliana (シロイヌナズナ)遺伝子: RAT5, H2A-1, At5g54640, MRB17.14 / 発現宿主:   Escherichia coli BL21 (大腸菌) / 参照: UniProt: Q9LD28 Escherichia coli BL21 (大腸菌) / 参照: UniProt: Q9LD28#4: タンパク質 | 分子量: 16474.459 Da / 分子数: 2 / 由来タイプ: 組換発現 由来: (組換発現)   Arabidopsis thaliana (シロイヌナズナ) Arabidopsis thaliana (シロイヌナズナ)遺伝子: H2B, At3g45980, F16L2.190 / 発現宿主:   Escherichia coli BL21 (大腸菌) / 参照: UniProt: O23629 Escherichia coli BL21 (大腸菌) / 参照: UniProt: O23629#7: タンパク質 | | 分子量: 86844.836 Da / 分子数: 1 / 由来タイプ: 組換発現 由来: (組換発現)   Arabidopsis thaliana (シロイヌナズナ) Arabidopsis thaliana (シロイヌナズナ)遺伝子: DDM1, CHA1, CHR1, SOM1, SOM4, At5g66750, MSN2.14 / 発現宿主:   Escherichia coli BL21 (大腸菌) / 参照: UniProt: Q9XFH4, Escherichia coli BL21 (大腸菌) / 参照: UniProt: Q9XFH4,  ヘリカーゼ ヘリカーゼ |
|---|
-DNA鎖 , 2種, 2分子 IJ
| #5: DNA鎖 | 分子量: 45123.758 Da / 分子数: 1 / 由来タイプ: 合成 / 由来: (合成) synthetic construct (人工物) |
|---|---|
| #6: DNA鎖 | 分子量: 45626.043 Da / 分子数: 1 / 由来タイプ: 合成 / 由来: (合成) synthetic construct (人工物) |
-非ポリマー , 2種, 2分子 


| #8: 化合物 | ChemComp-BEF / |
|---|---|
| #9: 化合物 | ChemComp-ADP /  アデノシン二リン酸 アデノシン二リン酸 |
-詳細
| 研究の焦点であるリガンドがあるか | Y |
|---|
-実験情報
-実験
| 実験 | 手法:  電子顕微鏡法 電子顕微鏡法 |
|---|---|
| EM実験 | 試料の集合状態: PARTICLE / 3次元再構成法:  単粒子再構成法 単粒子再構成法 |
- 試料調製
試料調製
| 構成要素 | 名称: DDM1-nucleosome complex in ADP-BeFx state / タイプ: COMPLEX / Entity ID: #1-#7 / 由来: RECOMBINANT |
|---|---|
| 分子量 | 値: 0.29 MDa / 実験値: NO |
| 由来(天然) | 生物種:   Arabidopsis thaliana (シロイヌナズナ) Arabidopsis thaliana (シロイヌナズナ) |
| 由来(組換発現) | 生物種:   Escherichia coli (大腸菌) Escherichia coli (大腸菌) |
| 緩衝液 | pH: 8 |
| 試料 | 濃度: 2.5 mg/ml / 包埋: NO / シャドウイング: NO / 染色 : NO / 凍結 : NO / 凍結 : YES : YES |
急速凍結 | 装置: FEI VITROBOT MARK IV / 凍結剤: ETHANE / 湿度: 100 % / 凍結前の試料温度: 277.15 K |
- 電子顕微鏡撮影
電子顕微鏡撮影
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
|---|---|
| 顕微鏡 | モデル: FEI TITAN KRIOS |
| 電子銃 | 電子線源 : :  FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: FLOOD BEAM FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: FLOOD BEAM |
| 電子レンズ | モード: BRIGHT FIELD Bright-field microscopy / 最大 デフォーカス(公称値): 2500 nm / 最小 デフォーカス(公称値): 1000 nm / Cs Bright-field microscopy / 最大 デフォーカス(公称値): 2500 nm / 最小 デフォーカス(公称値): 1000 nm / Cs : 2.7 mm : 2.7 mm |
| 試料ホルダ | 凍結剤: NITROGEN 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER |
| 撮影 | 電子線照射量: 50 e/Å2 / 検出モード: SUPER-RESOLUTION / フィルム・検出器のモデル: GATAN K3 (6k x 4k) / 実像数: 6776 |
| 画像スキャン | 動画フレーム数/画像: 32 / 利用したフレーム数/画像: 1-32 |
- 解析
解析
| EMソフトウェア | 名称: RELION / バージョン: 3.1 / カテゴリ: 3次元再構成 | ||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
CTF補正 | タイプ: PHASE FLIPPING AND AMPLITUDE CORRECTION | ||||||||||||||||||||||||
| 粒子像の選択 | 選択した粒子像数: 3898721 | ||||||||||||||||||||||||
3次元再構成 | 解像度: 3.31 Å / 解像度の算出法: FSC 0.143 CUT-OFF / 粒子像の数: 156597 / 対称性のタイプ: POINT | ||||||||||||||||||||||||
| 原子モデル構築 | 空間: REAL | ||||||||||||||||||||||||
| 拘束条件 |
|
 ムービー
ムービー コントローラー
コントローラー





 PDBj
PDBj








































