+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 8psm | ||||||
|---|---|---|---|---|---|---|---|
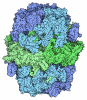
| タイトル | Asymmetric unit of the yeast fatty acid synthase in the non-rotated state with ACP at the malonyl/palmitoyl transferase domain (FASx sample) | ||||||
 要素 要素 |
| ||||||
 キーワード キーワード |  CYTOSOLIC PROTEIN (細胞質基質) / CYTOSOLIC PROTEIN (細胞質基質) /  Fatty acid synthase (脂肪酸合成酵素) / Fatty acid synthase (脂肪酸合成酵素) /  acyl carrier protein / FAS / ACP acyl carrier protein / FAS / ACP | ||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報: / fatty-acyl-CoA synthase system / : /  fatty-acyl-CoA synthase activity / fatty-acyl-CoA synthase activity /  fatty acid synthase complex / (3R)-hydroxyacyl-[acyl-carrier-protein] dehydratase activity / [acyl-carrier-protein] S-acetyltransferase / fatty acid synthase complex / (3R)-hydroxyacyl-[acyl-carrier-protein] dehydratase activity / [acyl-carrier-protein] S-acetyltransferase /  palmitoyltransferase activity / [acyl-carrier-protein] S-acetyltransferase activity / oleoyl-[acyl-carrier-protein] hydrolase ...: / fatty-acyl-CoA synthase system / : / palmitoyltransferase activity / [acyl-carrier-protein] S-acetyltransferase activity / oleoyl-[acyl-carrier-protein] hydrolase ...: / fatty-acyl-CoA synthase system / : /  fatty-acyl-CoA synthase activity / fatty-acyl-CoA synthase activity /  fatty acid synthase complex / (3R)-hydroxyacyl-[acyl-carrier-protein] dehydratase activity / [acyl-carrier-protein] S-acetyltransferase / fatty acid synthase complex / (3R)-hydroxyacyl-[acyl-carrier-protein] dehydratase activity / [acyl-carrier-protein] S-acetyltransferase /  palmitoyltransferase activity / [acyl-carrier-protein] S-acetyltransferase activity / oleoyl-[acyl-carrier-protein] hydrolase / (3R)-3-hydroxypalmitoyl-[acyl-carrier-protein] dehydratase activity / holo-[acyl-carrier-protein] synthase activity / [acyl-carrier-protein] S-malonyltransferase / [acyl-carrier-protein] S-malonyltransferase activity / palmitoyltransferase activity / [acyl-carrier-protein] S-acetyltransferase activity / oleoyl-[acyl-carrier-protein] hydrolase / (3R)-3-hydroxypalmitoyl-[acyl-carrier-protein] dehydratase activity / holo-[acyl-carrier-protein] synthase activity / [acyl-carrier-protein] S-malonyltransferase / [acyl-carrier-protein] S-malonyltransferase activity /  fatty acid synthase activity / 3-hydroxyacyl-[acyl-carrier-protein] dehydratase / (3R)-3-hydroxymyristoyl-[acyl-carrier-protein] dehydratase activity / beta-ketoacyl-[acyl-carrier-protein] synthase I / 3-oxoacyl-[acyl-carrier-protein] reductase / 3-oxoacyl-[acyl-carrier-protein] reductase (NADPH) activity / enoyl-[acyl-carrier-protein] reductase (NADH) / long-chain fatty acid biosynthetic process / enoyl-[acyl-carrier-protein] reductase (NADH) activity / 3-oxoacyl-[acyl-carrier-protein] synthase activity / fatty acid synthase activity / 3-hydroxyacyl-[acyl-carrier-protein] dehydratase / (3R)-3-hydroxymyristoyl-[acyl-carrier-protein] dehydratase activity / beta-ketoacyl-[acyl-carrier-protein] synthase I / 3-oxoacyl-[acyl-carrier-protein] reductase / 3-oxoacyl-[acyl-carrier-protein] reductase (NADPH) activity / enoyl-[acyl-carrier-protein] reductase (NADH) / long-chain fatty acid biosynthetic process / enoyl-[acyl-carrier-protein] reductase (NADH) activity / 3-oxoacyl-[acyl-carrier-protein] synthase activity /  lipid droplet / magnesium ion binding / lipid droplet / magnesium ion binding /  ミトコンドリア / ミトコンドリア /  細胞質基質 / 細胞質基質 /  細胞質 細胞質類似検索 - 分子機能 | ||||||
| 生物種 |   Saccharomyces cerevisiae (パン酵母) Saccharomyces cerevisiae (パン酵母) | ||||||
| 手法 |  電子顕微鏡法 / 電子顕微鏡法 /  単粒子再構成法 / 単粒子再構成法 /  クライオ電子顕微鏡法 / 解像度: 3.1 Å クライオ電子顕微鏡法 / 解像度: 3.1 Å | ||||||
 データ登録者 データ登録者 | Singh, K. / Bunzel, G. / Graf, B. / Yip, K.M. / Stark, H. / Chari, A. | ||||||
| 資金援助 |  ドイツ, 1件 ドイツ, 1件
| ||||||
 引用 引用 |  ジャーナル: Cell / 年: 2023 ジャーナル: Cell / 年: 2023タイトル: Reconstruction of a fatty acid synthesis cycle from acyl carrier protein and cofactor structural snapshots. 著者: Kashish Singh / Georg Bunzel / Benjamin Graf / Ka Man Yip / Meina Neumann-Schaal / Holger Stark / Ashwin Chari /  要旨: Fatty acids (FAs) play a central metabolic role in living cells as constituents of membranes, cellular energy reserves, and second messenger precursors. A 2.6 MDa FA synthase (FAS), where the ...Fatty acids (FAs) play a central metabolic role in living cells as constituents of membranes, cellular energy reserves, and second messenger precursors. A 2.6 MDa FA synthase (FAS), where the enzymatic reactions and structures are known, is responsible for FA biosynthesis in yeast. Essential in the yeast FAS catalytic cycle is the acyl carrier protein (ACP) that actively shuttles substrates, biosynthetic intermediates, and products from one active site to another. We resolve the S. cerevisiae FAS structure at 1.9 Å, elucidating cofactors and water networks involved in their recognition. Structural snapshots of ACP domains bound to various enzymatic domains allow the reconstruction of a full yeast FA biosynthesis cycle. The structural information suggests that each FAS functional unit could accommodate exogenous proteins to incorporate various enzymatic activities, and we show proof-of-concept experiments where ectopic proteins are used to modulate FAS product profiles. | ||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  8psm.cif.gz 8psm.cif.gz | 778.8 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb8psm.ent.gz pdb8psm.ent.gz | 605.4 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  8psm.json.gz 8psm.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/ps/8psm https://data.pdbj.org/pub/pdb/validation_reports/ps/8psm ftp://data.pdbj.org/pub/pdb/validation_reports/ps/8psm ftp://data.pdbj.org/pub/pdb/validation_reports/ps/8psm | HTTPS FTP |
|---|
-関連構造データ
| 関連構造データ |  17856MC  8prvC  8prwC  8ps1C  8ps2C  8ps8C  8ps9C  8psaC  8psfC  8psgC  8psjC  8pskC  8pslC  8pspC M: このデータのモデリングに利用したマップデータ C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
|
|---|---|
| 1 |
|
- 要素
要素
| #1: タンパク質 |  脂肪酸合成酵素 脂肪酸合成酵素分子量: 207184.422 Da / 分子数: 2 / 由来タイプ: 天然 / 由来: (天然)   Saccharomyces cerevisiae (パン酵母) Saccharomyces cerevisiae (パン酵母)参照: UniProt: P19097, fatty-acyl-CoA synthase system, 3-oxoacyl-[acyl-carrier-protein] reductase, beta-ketoacyl-[acyl-carrier-protein] synthase I #2: タンパク質 | |  脂肪酸合成酵素 脂肪酸合成酵素分子量: 228940.375 Da / 分子数: 1 / 由来タイプ: 天然 / 由来: (天然)   Saccharomyces cerevisiae (パン酵母) Saccharomyces cerevisiae (パン酵母)参照: UniProt: P07149, fatty-acyl-CoA synthase system, 3-hydroxyacyl-[acyl-carrier-protein] dehydratase, enoyl-[acyl-carrier-protein] reductase (NADH), [acyl-carrier-protein] S-acetyltransferase, ...参照: UniProt: P07149, fatty-acyl-CoA synthase system, 3-hydroxyacyl-[acyl-carrier-protein] dehydratase, enoyl-[acyl-carrier-protein] reductase (NADH), [acyl-carrier-protein] S-acetyltransferase, [acyl-carrier-protein] S-malonyltransferase, oleoyl-[acyl-carrier-protein] hydrolase #3: 化合物 | ChemComp-PNS / |  Phosphopantetheine Phosphopantetheine#4: 化合物 | ChemComp-FMN / |  フラビンモノヌクレオチド フラビンモノヌクレオチド研究の焦点であるリガンドがあるか | Y | |
|---|
-実験情報
-実験
| 実験 | 手法:  電子顕微鏡法 電子顕微鏡法 |
|---|---|
| EM実験 | 試料の集合状態: PARTICLE / 3次元再構成法:  単粒子再構成法 単粒子再構成法 |
- 試料調製
試料調製
| 構成要素 | 名称: Yeast fatty acid synthase 脂肪酸合成酵素 / タイプ: COMPLEX / Entity ID: #2 / 由来: NATURAL 脂肪酸合成酵素 / タイプ: COMPLEX / Entity ID: #2 / 由来: NATURAL |
|---|---|
| 由来(天然) | 生物種:   Saccharomyces cerevisiae (パン酵母) Saccharomyces cerevisiae (パン酵母) |
| 緩衝液 | pH: 6.5 |
| 試料 | 包埋: NO / シャドウイング: NO / 染色 : NO / 凍結 : NO / 凍結 : YES : YES |
急速凍結 | 凍結剤: ETHANE |
- 電子顕微鏡撮影
電子顕微鏡撮影
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
|---|---|
| 顕微鏡 | モデル: FEI TITAN KRIOS |
| 電子銃 | 電子線源 : :  FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: FLOOD BEAM FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: FLOOD BEAM |
| 電子レンズ | モード: BRIGHT FIELD Bright-field microscopy / 最大 デフォーカス(公称値): 25000 nm / 最小 デフォーカス(公称値): 5000 nm Bright-field microscopy / 最大 デフォーカス(公称値): 25000 nm / 最小 デフォーカス(公称値): 5000 nm |
| 撮影 | 電子線照射量: 50 e/Å2 / 検出モード: COUNTING フィルム・検出器のモデル: FEI FALCON III (4k x 4k) |
- 解析
解析
| EMソフトウェア |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
CTF補正 | タイプ: PHASE FLIPPING AND AMPLITUDE CORRECTION | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
3次元再構成 | 解像度: 3.1 Å / 解像度の算出法: FSC 0.143 CUT-OFF / 粒子像の数: 58437 / 対称性のタイプ: POINT | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化 | 解像度: 3.1→182.51 Å / Cor.coef. Fo:Fc: 0.903 / SU B: 9.581 / SU ML: 0.16 / ESU R: 0.272 立体化学のターゲット値: MAXIMUM LIKELIHOOD WITH PHASES 詳細: HYDROGENS HAVE BEEN ADDED IN THE RIDING POSITIONS
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 溶媒の処理 | イオンプローブ半径: 0.8 Å / 減衰半径: 0.8 Å / VDWプローブ半径: 1.2 Å / 溶媒モデル: MASK | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子変位パラメータ | Biso mean: 101.27 Å2
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化ステップ | サイクル: 1 / 合計: 29625 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 拘束条件 |
|
 ムービー
ムービー コントローラー
コントローラー
















 PDBj
PDBj