+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 8ohi | ||||||
|---|---|---|---|---|---|---|---|
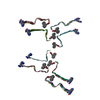
| タイトル | Structure of the Fmoc-Tau-PAM4 Type 2 amyloid fibril | ||||||
 要素 要素 | Microtubule-associated protein tau タウタンパク質 タウタンパク質 | ||||||
 キーワード キーワード | PROTEIN FIBRIL /  amyloid (アミロイド) / tau / helical / cross-beta / amyloid (アミロイド) / tau / helical / cross-beta /  fibril (フィブリル) / fibril (フィブリル) /  neurodegeneration (神経変性疾患) / Fmoc neurodegeneration (神経変性疾患) / Fmoc | ||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報plus-end-directed organelle transport along microtubule /  軸索輸送 / histone-dependent DNA binding / 軸索輸送 / histone-dependent DNA binding /  neurofibrillary tangle assembly / positive regulation of diacylglycerol kinase activity / negative regulation of establishment of protein localization to mitochondrion / neurofibrillary tangle assembly / positive regulation of diacylglycerol kinase activity / negative regulation of establishment of protein localization to mitochondrion /  neurofibrillary tangle / positive regulation of protein localization to synapse / microtubule lateral binding / neurofibrillary tangle / positive regulation of protein localization to synapse / microtubule lateral binding /  tubulin complex ...plus-end-directed organelle transport along microtubule / tubulin complex ...plus-end-directed organelle transport along microtubule /  軸索輸送 / histone-dependent DNA binding / 軸索輸送 / histone-dependent DNA binding /  neurofibrillary tangle assembly / positive regulation of diacylglycerol kinase activity / negative regulation of establishment of protein localization to mitochondrion / neurofibrillary tangle assembly / positive regulation of diacylglycerol kinase activity / negative regulation of establishment of protein localization to mitochondrion /  neurofibrillary tangle / positive regulation of protein localization to synapse / microtubule lateral binding / neurofibrillary tangle / positive regulation of protein localization to synapse / microtubule lateral binding /  tubulin complex / tubulin complex /  phosphatidylinositol bisphosphate binding / main axon / regulation of long-term synaptic depression / negative regulation of kinase activity / negative regulation of tubulin deacetylation / generation of neurons / regulation of chromosome organization / positive regulation of protein localization / rRNA metabolic process / internal protein amino acid acetylation / phosphatidylinositol bisphosphate binding / main axon / regulation of long-term synaptic depression / negative regulation of kinase activity / negative regulation of tubulin deacetylation / generation of neurons / regulation of chromosome organization / positive regulation of protein localization / rRNA metabolic process / internal protein amino acid acetylation /  regulation of mitochondrial fission / intracellular distribution of mitochondria / axonal transport of mitochondrion / axon development / regulation of mitochondrial fission / intracellular distribution of mitochondria / axonal transport of mitochondrion / axon development /  central nervous system neuron development / central nervous system neuron development /  regulation of microtubule polymerization / regulation of microtubule polymerization /  微小管 / minor groove of adenine-thymine-rich DNA binding / 微小管 / minor groove of adenine-thymine-rich DNA binding /  lipoprotein particle binding / lipoprotein particle binding /  dynactin binding / glial cell projection / negative regulation of mitochondrial membrane potential / dynactin binding / glial cell projection / negative regulation of mitochondrial membrane potential /  apolipoprotein binding / protein polymerization / negative regulation of mitochondrial fission / apolipoprotein binding / protein polymerization / negative regulation of mitochondrial fission /  axolemma / Caspase-mediated cleavage of cytoskeletal proteins / regulation of microtubule polymerization or depolymerization / positive regulation of axon extension / supramolecular fiber organization / Activation of AMPK downstream of NMDARs / regulation of microtubule cytoskeleton organization / cytoplasmic microtubule organization / axolemma / Caspase-mediated cleavage of cytoskeletal proteins / regulation of microtubule polymerization or depolymerization / positive regulation of axon extension / supramolecular fiber organization / Activation of AMPK downstream of NMDARs / regulation of microtubule cytoskeleton organization / cytoplasmic microtubule organization /  stress granule assembly / regulation of cellular response to heat / axon cytoplasm / regulation of calcium-mediated signaling / positive regulation of microtubule polymerization / cellular response to brain-derived neurotrophic factor stimulus / somatodendritic compartment / stress granule assembly / regulation of cellular response to heat / axon cytoplasm / regulation of calcium-mediated signaling / positive regulation of microtubule polymerization / cellular response to brain-derived neurotrophic factor stimulus / somatodendritic compartment /  synapse assembly / synapse assembly /  phosphatidylinositol binding / nuclear periphery / cellular response to nerve growth factor stimulus / positive regulation of superoxide anion generation / protein phosphatase 2A binding / phosphatidylinositol binding / nuclear periphery / cellular response to nerve growth factor stimulus / positive regulation of superoxide anion generation / protein phosphatase 2A binding /  regulation of autophagy / astrocyte activation / synapse organization / response to lead ion / microglial cell activation / regulation of autophagy / astrocyte activation / synapse organization / response to lead ion / microglial cell activation /  regulation of synaptic plasticity / regulation of synaptic plasticity /  Hsp90 protein binding / PKR-mediated signaling / protein homooligomerization / cytoplasmic ribonucleoprotein granule / Hsp90 protein binding / PKR-mediated signaling / protein homooligomerization / cytoplasmic ribonucleoprotein granule /  記憶 / microtubule cytoskeleton organization / cellular response to reactive oxygen species / 記憶 / microtubule cytoskeleton organization / cellular response to reactive oxygen species /  SH3 domain binding / activation of cysteine-type endopeptidase activity involved in apoptotic process / neuron projection development / microtubule cytoskeleton / protein-macromolecule adaptor activity / SH3 domain binding / activation of cysteine-type endopeptidase activity involved in apoptotic process / neuron projection development / microtubule cytoskeleton / protein-macromolecule adaptor activity /  single-stranded DNA binding / cell-cell signaling / cellular response to heat / single-stranded DNA binding / cell-cell signaling / cellular response to heat /  cell body / cell body /  actin binding / actin binding /  成長円錐 / protein-folding chaperone binding / 成長円錐 / protein-folding chaperone binding /  double-stranded DNA binding / double-stranded DNA binding /  microtubule binding / microtubule binding /  微小管 / amyloid fibril formation / sequence-specific DNA binding / 微小管 / amyloid fibril formation / sequence-specific DNA binding /  樹状突起スパイン / learning or memory / neuron projection / nuclear speck / 樹状突起スパイン / learning or memory / neuron projection / nuclear speck /  脂質ラフト / 脂質ラフト /  神経繊維 / negative regulation of gene expression / neuronal cell body / 神経繊維 / negative regulation of gene expression / neuronal cell body /  樹状突起 / DNA damage response / 樹状突起 / DNA damage response /  protein kinase binding / protein kinase binding /  enzyme binding / enzyme binding /  ミトコンドリア / ミトコンドリア /  DNA binding DNA binding類似検索 - 分子機能 | ||||||
| 生物種 | synthetic construct (人工物) | ||||||
| 手法 |  電子顕微鏡法 / らせん対称体再構成法 / 電子顕微鏡法 / らせん対称体再構成法 /  クライオ電子顕微鏡法 / 解像度: 2.8 Å クライオ電子顕微鏡法 / 解像度: 2.8 Å | ||||||
 データ登録者 データ登録者 | Wilkinson, M. / Louros, N. / Tsaka, G. / Ramakers, M. / Morelli, C. / Garcia, T. / Gallardo, R.U. / D'Haeyer, S. / Goossens, V. / Audenaert, D. ...Wilkinson, M. / Louros, N. / Tsaka, G. / Ramakers, M. / Morelli, C. / Garcia, T. / Gallardo, R.U. / D'Haeyer, S. / Goossens, V. / Audenaert, D. / Thal, D.R. / Ranson, N.A. / Radford, S.E. / Rousseau, F. / Schymkowitz, J. | ||||||
| 資金援助 |  ベルギー, 1件 ベルギー, 1件
| ||||||
 引用 引用 |  ジャーナル: Nat Commun / 年: 2024 ジャーナル: Nat Commun / 年: 2024タイトル: Local structural preferences in shaping tau amyloid polymorphism. 著者: Nikolaos Louros / Martin Wilkinson / Grigoria Tsaka / Meine Ramakers / Chiara Morelli / Teresa Garcia / Rodrigo Gallardo / Sam D'Haeyer / Vera Goossens / Dominique Audenaert / Dietmar Rudolf ...著者: Nikolaos Louros / Martin Wilkinson / Grigoria Tsaka / Meine Ramakers / Chiara Morelli / Teresa Garcia / Rodrigo Gallardo / Sam D'Haeyer / Vera Goossens / Dominique Audenaert / Dietmar Rudolf Thal / Ian R Mackenzie / Rosa Rademakers / Neil A Ranson / Sheena E Radford / Frederic Rousseau / Joost Schymkowitz /    要旨: Tauopathies encompass a group of neurodegenerative disorders characterised by diverse tau amyloid fibril structures. The persistence of polymorphism across tauopathies suggests that distinct ...Tauopathies encompass a group of neurodegenerative disorders characterised by diverse tau amyloid fibril structures. The persistence of polymorphism across tauopathies suggests that distinct pathological conditions dictate the adopted polymorph for each disease. However, the extent to which intrinsic structural tendencies of tau amyloid cores contribute to fibril polymorphism remains uncertain. Using a combination of experimental approaches, we here identify a new amyloidogenic motif, PAM4 (Polymorphic Amyloid Motif of Repeat 4), as a significant contributor to tau polymorphism. Calculation of per-residue contributions to the stability of the fibril cores of different pathologic tau structures suggests that PAM4 plays a central role in preserving structural integrity across amyloid polymorphs. Consistent with this, cryo-EM structural analysis of fibrils formed from a synthetic PAM4 peptide shows that the sequence adopts alternative structures that closely correspond to distinct disease-associated tau strains. Furthermore, in-cell experiments revealed that PAM4 deletion hampers the cellular seeding efficiency of tau aggregates extracted from Alzheimer's disease, corticobasal degeneration, and progressive supranuclear palsy patients, underscoring PAM4's pivotal role in these tauopathies. Together, our results highlight the importance of the intrinsic structural propensity of amyloid core segments to determine the structure of tau in cells, and in propagating amyloid structures in disease. | ||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  8ohi.cif.gz 8ohi.cif.gz | 55.8 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb8ohi.ent.gz pdb8ohi.ent.gz | 44.9 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  8ohi.json.gz 8ohi.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/oh/8ohi https://data.pdbj.org/pub/pdb/validation_reports/oh/8ohi ftp://data.pdbj.org/pub/pdb/validation_reports/oh/8ohi ftp://data.pdbj.org/pub/pdb/validation_reports/oh/8ohi | HTTPS FTP |
|---|
-関連構造データ
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
|
|---|---|
| 1 |
|
- 要素
要素
| #1: タンパク質・ペプチド |  タウタンパク質 / Neurofibrillary tangle protein / Paired helical filament-tau / PHF-tau タウタンパク質 / Neurofibrillary tangle protein / Paired helical filament-tau / PHF-tau分子量: 1652.269 Da / 分子数: 18 / 由来タイプ: 合成 詳細: 13-residue peptide of the PAM4 motif of Tau, corresponding to residues 350-362 of the Tau repeat domain. The peptide is supposed to be N-terminally acetylated but 10% (by mass spec) was still ...詳細: 13-residue peptide of the PAM4 motif of Tau, corresponding to residues 350-362 of the Tau repeat domain. The peptide is supposed to be N-terminally acetylated but 10% (by mass spec) was still adducted to the Fmoc protection group from synthesis. The peptide in the fibrils is dominated by this impurity. The peptide is also C-terminally amidated. 由来: (合成) synthetic construct (人工物) / 参照: UniProt: P10636 研究の焦点であるリガンドがあるか | Y | |
|---|
-実験情報
-実験
| 実験 | 手法:  電子顕微鏡法 電子顕微鏡法 |
|---|---|
| EM実験 | 試料の集合状態: FILAMENT / 3次元再構成法: らせん対称体再構成法 |
- 試料調製
試料調製
| 構成要素 | 名称: Amyloid fibril form 1a of Tau-PAM4 peptide adducted with the Fmoc protection group タイプ: COMPLEX / 詳細: Synthesised peptide assembled into amyloid fibril / Entity ID: all / 由来: NATURAL |
|---|---|
| 分子量 | 実験値: NO |
| 由来(天然) | 生物種: synthetic construct (人工物) |
| 緩衝液 | pH: 7 詳細: Peptide resuspended in MilliQ water for aggregation reaction |
| 試料 | 濃度: 0.6 mg/ml / 包埋: NO / シャドウイング: NO / 染色 : NO / 凍結 : NO / 凍結 : YES : YES |
| 試料支持 | グリッドの材料: COPPER / グリッドのサイズ: 300 divisions/in. / グリッドのタイプ: EMS Lacey Carbon |
急速凍結 | 装置: FEI VITROBOT MARK IV / 凍結剤: ETHANE / 湿度: 90 % / 凍結前の試料温度: 279 K |
- 電子顕微鏡撮影
電子顕微鏡撮影
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
|---|---|
| 顕微鏡 | モデル: FEI TITAN KRIOS |
| 電子銃 | 電子線源 : :  FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: FLOOD BEAM FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: FLOOD BEAM |
| 電子レンズ | モード: BRIGHT FIELD Bright-field microscopy / 倍率(公称値): 130000 X / 最大 デフォーカス(公称値): 2400 nm / 最小 デフォーカス(公称値): 1200 nm / Cs Bright-field microscopy / 倍率(公称値): 130000 X / 最大 デフォーカス(公称値): 2400 nm / 最小 デフォーカス(公称値): 1200 nm / Cs : 2.7 mm / C2レンズ絞り径: 50 µm / アライメント法: COMA FREE : 2.7 mm / C2レンズ絞り径: 50 µm / アライメント法: COMA FREE |
| 試料ホルダ | 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER |
| 撮影 | 平均露光時間: 5 sec. / 電子線照射量: 32 e/Å2 フィルム・検出器のモデル: FEI FALCON IV (4k x 4k) 撮影したグリッド数: 1 / 実像数: 1957 詳細: Movies were collected as 1204 EER frames compressed and re-grouped into 35 TIF fractions |
| 電子光学装置 | エネルギーフィルター名称 : TFS Selectris / エネルギーフィルタースリット幅: 10 eV : TFS Selectris / エネルギーフィルタースリット幅: 10 eV |
| 画像スキャン | 横: 4096 / 縦: 4096 |
- 解析
解析
| EMソフトウェア |
| ||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
CTF補正 | タイプ: PHASE FLIPPING AND AMPLITUDE CORRECTION | ||||||||||||||||||||||||||||||||||||||||
| らせん対称 | 回転角度/サブユニット: -1.45 ° / 軸方向距離/サブユニット: 4.8 Å / らせん対称軸の対称性: C1 | ||||||||||||||||||||||||||||||||||||||||
| 粒子像の選択 | 選択した粒子像数: 520390 | ||||||||||||||||||||||||||||||||||||||||
3次元再構成 | 解像度: 2.8 Å / 解像度の算出法: FSC 0.143 CUT-OFF / 粒子像の数: 11255 / 対称性のタイプ: HELICAL | ||||||||||||||||||||||||||||||||||||||||
| 原子モデル構築 | B value: 48 / プロトコル: AB INITIO MODEL / 空間: REAL / Target criteria: Cross-correlation coefficient 詳細: Initial model built manually in coot, no starting template | ||||||||||||||||||||||||||||||||||||||||
| 拘束条件 |
|
 ムービー
ムービー コントローラー
コントローラー









 PDBj
PDBj





