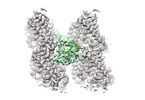
登録情報 データベース : EMDB / ID : EMD-4654タイトル HsCKK (human CAMSAP1) decorated 14pf taxol-GDP microtubule HsCKK (Human CKK) decorated 14pf taxol-GDP microtubule (symmetrised asymmetric unit) 複合体 : HsCKK (human CAMSAP1) decorated 14pf taxol-GDP microtubule複合体 : CAMSAP1タンパク質・ペプチド : Calmodulin-regulated spectrin-associated protein 1複合体 : tubilinタンパク質・ペプチド : Tubulin alpha-1B chainタンパク質・ペプチド : Tubulin beta chainリガンド : GUANOSINE-5'-TRIPHOSPHATEリガンド : MAGNESIUM IONリガンド : GUANOSINE-5'-DIPHOSPHATEリガンド : TAXOL / 機能・相同性 分子機能 ドメイン・相同性 構成要素
/ / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / 生物種 Homo sapiens (ヒト)手法 / / 解像度 : 3.8 Å Atherton JM / Luo Y 資金援助 Organization Grant number 国 Medical Research Council (United Kingdom) MR/R000352/1 Swiss National Science Foundation 31003A_166608
ジャーナル : Nat Commun / 年 : 2019タイトル : Structural determinants of microtubule minus end preference in CAMSAP CKK domains.著者: Joseph Atherton / Yanzhang Luo / Shengqi Xiang / Chao Yang / Ankit Rai / Kai Jiang / Marcel Stangier / Annapurna Vemu / Alexander D Cook / Su Wang / Antonina Roll-Mecak / Michel O Steinmetz / ... 著者 : Joseph Atherton / Yanzhang Luo / Shengqi Xiang / Chao Yang / Ankit Rai / Kai Jiang / Marcel Stangier / Annapurna Vemu / Alexander D Cook / Su Wang / Antonina Roll-Mecak / Michel O Steinmetz / Anna Akhmanova / Marc Baldus / Carolyn A Moores / 要旨 : CAMSAP/Patronins regulate microtubule minus-end dynamics. Their end specificity is mediated by their CKK domains, which we proposed recognise specific tubulin conformations found at minus ends. To ... CAMSAP/Patronins regulate microtubule minus-end dynamics. Their end specificity is mediated by their CKK domains, which we proposed recognise specific tubulin conformations found at minus ends. To critically test this idea, we compared the human CAMSAP1 CKK domain (HsCKK) with a CKK domain from Naegleria gruberi (NgCKK), which lacks minus-end specificity. Here we report near-atomic cryo-electron microscopy structures of HsCKK- and NgCKK-microtubule complexes, which show that these CKK domains share the same protein fold, bind at the intradimer interprotofilament tubulin junction, but exhibit different footprints on microtubules. NMR experiments show that both HsCKK and NgCKK are remarkably rigid. However, whereas NgCKK binding does not alter the microtubule architecture, HsCKK remodels its microtubule interaction site and changes the underlying polymer structure because the tubulin lattice conformation is not optimal for its binding. Thus, in contrast to many MAPs, the HsCKK domain can differentiate subtly specific tubulin conformations to enable microtubule minus-end recognition. 履歴 登録 2019年3月2日 - ヘッダ(付随情報) 公開 2019年11月27日 - マップ公開 2019年11月27日 - 更新 2024年5月15日 - 現状 2024年5月15日 処理サイト : PDBe / 状態 : 公開
すべて表示 表示を減らす
 データを開く
データを開く 基本情報
基本情報 マップデータ
マップデータ 試料
試料 キーワード
キーワード STRUCTURAL PROTEIN (タンパク質)
STRUCTURAL PROTEIN (タンパク質) 機能・相同性情報
機能・相同性情報 Cilium Assembly / cytoskeleton-dependent intracellular transport /
Cilium Assembly / cytoskeleton-dependent intracellular transport /  Intraflagellar transport / Sealing of the nuclear envelope (NE) by ESCRT-III /
Intraflagellar transport / Sealing of the nuclear envelope (NE) by ESCRT-III /  Gap junction assembly ...microtubule minus-end binding / odontoblast differentiation / Post-chaperonin tubulin folding pathway / Carboxyterminal post-translational modifications of tubulin / Microtubule-dependent trafficking of connexons from Golgi to the plasma membrane /
Gap junction assembly ...microtubule minus-end binding / odontoblast differentiation / Post-chaperonin tubulin folding pathway / Carboxyterminal post-translational modifications of tubulin / Microtubule-dependent trafficking of connexons from Golgi to the plasma membrane /  Cilium Assembly / cytoskeleton-dependent intracellular transport /
Cilium Assembly / cytoskeleton-dependent intracellular transport /  Intraflagellar transport / Sealing of the nuclear envelope (NE) by ESCRT-III /
Intraflagellar transport / Sealing of the nuclear envelope (NE) by ESCRT-III /  Gap junction assembly / Formation of tubulin folding intermediates by CCT/TriC / COPI-independent Golgi-to-ER retrograde traffic / natural killer cell mediated cytotoxicity / Kinesins / Assembly and cell surface presentation of NMDA receptors / regulation of cell morphogenesis / GTPase activating protein binding /
Gap junction assembly / Formation of tubulin folding intermediates by CCT/TriC / COPI-independent Golgi-to-ER retrograde traffic / natural killer cell mediated cytotoxicity / Kinesins / Assembly and cell surface presentation of NMDA receptors / regulation of cell morphogenesis / GTPase activating protein binding /  微小管形成中心 / COPI-dependent Golgi-to-ER retrograde traffic /
微小管形成中心 / COPI-dependent Golgi-to-ER retrograde traffic /  spectrin binding / regulation of synapse organization /
spectrin binding / regulation of synapse organization /  細胞結合 / nuclear envelope lumen /
細胞結合 / nuclear envelope lumen /  regulation of microtubule polymerization / Recycling pathway of L1 / RHOH GTPase cycle / RHO GTPases activate IQGAPs / spindle assembly / MHC class I protein binding / Hedgehog 'off' state / cytoplasmic microtubule / microtubule-based process / COPI-mediated anterograde transport / Activation of AMPK downstream of NMDARs / Mitotic Prometaphase / EML4 and NUDC in mitotic spindle formation / Loss of Nlp from mitotic centrosomes / Loss of proteins required for interphase microtubule organization from the centrosome / Recruitment of mitotic centrosome proteins and complexes / cytoskeleton organization / Resolution of Sister Chromatid Cohesion / Recruitment of NuMA to mitotic centrosomes / HSP90 chaperone cycle for steroid hormone receptors (SHR) in the presence of ligand / Anchoring of the basal body to the plasma membrane / MHC class II antigen presentation / cellular response to interleukin-4 / AURKA Activation by TPX2 / Translocation of SLC2A4 (GLUT4) to the plasma membrane / RHO GTPases Activate Formins /
regulation of microtubule polymerization / Recycling pathway of L1 / RHOH GTPase cycle / RHO GTPases activate IQGAPs / spindle assembly / MHC class I protein binding / Hedgehog 'off' state / cytoplasmic microtubule / microtubule-based process / COPI-mediated anterograde transport / Activation of AMPK downstream of NMDARs / Mitotic Prometaphase / EML4 and NUDC in mitotic spindle formation / Loss of Nlp from mitotic centrosomes / Loss of proteins required for interphase microtubule organization from the centrosome / Recruitment of mitotic centrosome proteins and complexes / cytoskeleton organization / Resolution of Sister Chromatid Cohesion / Recruitment of NuMA to mitotic centrosomes / HSP90 chaperone cycle for steroid hormone receptors (SHR) in the presence of ligand / Anchoring of the basal body to the plasma membrane / MHC class II antigen presentation / cellular response to interleukin-4 / AURKA Activation by TPX2 / Translocation of SLC2A4 (GLUT4) to the plasma membrane / RHO GTPases Activate Formins /  加水分解酵素; 酸無水物に作用; GTPに作用・細胞または細胞小器官の運動に関与 / PKR-mediated signaling / structural constituent of cytoskeleton / cytoplasmic ribonucleoprotein granule /
加水分解酵素; 酸無水物に作用; GTPに作用・細胞または細胞小器官の運動に関与 / PKR-mediated signaling / structural constituent of cytoskeleton / cytoplasmic ribonucleoprotein granule /  紡錘体 / microtubule cytoskeleton organization / Aggrephagy / HCMV Early Events / Separation of Sister Chromatids / The role of GTSE1 in G2/M progression after G2 checkpoint / neuron projection development / microtubule cytoskeleton / azurophil granule lumen /
紡錘体 / microtubule cytoskeleton organization / Aggrephagy / HCMV Early Events / Separation of Sister Chromatids / The role of GTSE1 in G2/M progression after G2 checkpoint / neuron projection development / microtubule cytoskeleton / azurophil granule lumen /  Regulation of PLK1 Activity at G2/M Transition /
Regulation of PLK1 Activity at G2/M Transition /  double-stranded RNA binding / mitotic cell cycle /
double-stranded RNA binding / mitotic cell cycle /  cell body /
cell body /  microtubule binding /
microtubule binding /  微小管 / Potential therapeutics for SARS /
微小管 / Potential therapeutics for SARS /  細胞骨格 /
細胞骨格 /  calmodulin binding /
calmodulin binding /  脂質ラフト /
脂質ラフト /  細胞分裂 / protein domain specific binding /
細胞分裂 / protein domain specific binding /  GTPase activity /
GTPase activity /  ubiquitin protein ligase binding / Neutrophil degranulation / protein-containing complex binding / GTP binding / structural molecule activity / protein-containing complex / extracellular exosome / extracellular region /
ubiquitin protein ligase binding / Neutrophil degranulation / protein-containing complex binding / GTP binding / structural molecule activity / protein-containing complex / extracellular exosome / extracellular region /  metal ion binding /
metal ion binding /  細胞核 /
細胞核 /  細胞質基質 /
細胞質基質 /  細胞質
細胞質
 Homo sapiens (ヒト)
Homo sapiens (ヒト) 単粒子再構成法 /
単粒子再構成法 /  クライオ電子顕微鏡法 / 解像度: 3.8 Å
クライオ電子顕微鏡法 / 解像度: 3.8 Å  データ登録者
データ登録者 英国,
英国,  スイス, 2件
スイス, 2件  引用
引用 ジャーナル: Nat Commun / 年: 2019
ジャーナル: Nat Commun / 年: 2019




 構造の表示
構造の表示 ムービービューア
ムービービューア SurfView
SurfView Molmil
Molmil Jmol/JSmol
Jmol/JSmol ダウンロードとリンク
ダウンロードとリンク emd_4654.map.gz
emd_4654.map.gz EMDBマップデータ形式
EMDBマップデータ形式 emd-4654-v30.xml
emd-4654-v30.xml emd-4654.xml
emd-4654.xml EMDBヘッダ
EMDBヘッダ emd_4654.png
emd_4654.png emd-4654.cif.gz
emd-4654.cif.gz emd_4654_additional.map.gz
emd_4654_additional.map.gz http://ftp.pdbj.org/pub/emdb/structures/EMD-4654
http://ftp.pdbj.org/pub/emdb/structures/EMD-4654 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-4654
ftp://ftp.pdbj.org/pub/emdb/structures/EMD-4654 リンク
リンク EMDB (EBI/PDBe) /
EMDB (EBI/PDBe) /  EMDataResource
EMDataResource マップ
マップ ダウンロード / ファイル: emd_4654.map.gz / 形式: CCP4 / 大きさ: 307.5 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES)
ダウンロード / ファイル: emd_4654.map.gz / 形式: CCP4 / 大きさ: 307.5 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) 試料の構成要素
試料の構成要素 クライオ電子顕微鏡法
クライオ電子顕微鏡法 解析
解析 単粒子再構成法
単粒子再構成法 試料調製
試料調製 電子顕微鏡法
電子顕微鏡法 FIELD EMISSION GUN
FIELD EMISSION GUN Bright-field microscopy
Bright-field microscopy
 画像解析
画像解析
 ムービー
ムービー コントローラー
コントローラー













































 Z
Z Y
Y X
X