+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Cryo-EM structure of the human nucleosome core particle ubiquitylated at histone H2A lysine 15 in complex with RNF168-UbcH5c (class 2) | |||||||||
 マップデータ マップデータ | ||||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード |  Nucleosome core particle (ヌクレオソーム) / Nucleosome core particle (ヌクレオソーム) /  chromatin (クロマチン) / RNF168 / UbcH5c / chromatin (クロマチン) / RNF168 / UbcH5c /  DNA repair (DNA修復) / DNA double-strand break / DNA repair (DNA修復) / DNA double-strand break /  Homologous recombination (相同組換え) / BRCA1-BARD1 / Homologous recombination (相同組換え) / BRCA1-BARD1 /  53BP1 / 53BP1 /  ubiquitin (ユビキチン) / ubiquitin (ユビキチン) /  STRUCTURAL PROTEIN-DNA-TRANSFERASE complex (構造) STRUCTURAL PROTEIN-DNA-TRANSFERASE complex (構造) | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報histone H2AK15 ubiquitin ligase activity / histone ubiquitin ligase activity / (E3-independent) E2 ubiquitin-conjugating enzyme / protein K6-linked ubiquitination / Signaling by BMP /  クラススイッチ / double-strand break repair via classical nonhomologous end joining / protein K11-linked ubiquitination / DNA repair-dependent chromatin remodeling / positive regulation of protein targeting to mitochondrion ...histone H2AK15 ubiquitin ligase activity / histone ubiquitin ligase activity / (E3-independent) E2 ubiquitin-conjugating enzyme / protein K6-linked ubiquitination / Signaling by BMP / クラススイッチ / double-strand break repair via classical nonhomologous end joining / protein K11-linked ubiquitination / DNA repair-dependent chromatin remodeling / positive regulation of protein targeting to mitochondrion ...histone H2AK15 ubiquitin ligase activity / histone ubiquitin ligase activity / (E3-independent) E2 ubiquitin-conjugating enzyme / protein K6-linked ubiquitination / Signaling by BMP /  クラススイッチ / double-strand break repair via classical nonhomologous end joining / protein K11-linked ubiquitination / DNA repair-dependent chromatin remodeling / positive regulation of protein targeting to mitochondrion / クラススイッチ / double-strand break repair via classical nonhomologous end joining / protein K11-linked ubiquitination / DNA repair-dependent chromatin remodeling / positive regulation of protein targeting to mitochondrion /  ユビキチン結合酵素 / K63-linked polyubiquitin modification-dependent protein binding / response to ionizing radiation / negative regulation of transcription elongation by RNA polymerase II / ubiquitin conjugating enzyme activity / protein monoubiquitination / protein K63-linked ubiquitination / negative regulation of BMP signaling pathway / ユビキチン結合酵素 / K63-linked polyubiquitin modification-dependent protein binding / response to ionizing radiation / negative regulation of transcription elongation by RNA polymerase II / ubiquitin conjugating enzyme activity / protein monoubiquitination / protein K63-linked ubiquitination / negative regulation of BMP signaling pathway /  nucleosome binding / negative regulation of tumor necrosis factor-mediated signaling pathway / protein K48-linked ubiquitination / protein autoubiquitination / negative regulation of megakaryocyte differentiation / protein localization to CENP-A containing chromatin / interstrand cross-link repair / Chromatin modifying enzymes / Replacement of protamines by nucleosomes in the male pronucleus / CENP-A containing nucleosome / nucleosome binding / negative regulation of tumor necrosis factor-mediated signaling pathway / protein K48-linked ubiquitination / protein autoubiquitination / negative regulation of megakaryocyte differentiation / protein localization to CENP-A containing chromatin / interstrand cross-link repair / Chromatin modifying enzymes / Replacement of protamines by nucleosomes in the male pronucleus / CENP-A containing nucleosome /  ubiquitin ligase complex / SUMOylation of DNA damage response and repair proteins / epigenetic regulation of gene expression / Packaging Of Telomere Ends / Recognition and association of DNA glycosylase with site containing an affected purine / Cleavage of the damaged purine / Deposition of new CENPA-containing nucleosomes at the centromere / Recognition and association of DNA glycosylase with site containing an affected pyrimidine / Cleavage of the damaged pyrimidine / Inhibition of DNA recombination at telomere / positive regulation of DNA repair / Meiotic synapsis / telomere organization / RNA Polymerase I Promoter Opening / Interleukin-7 signaling / Assembly of the ORC complex at the origin of replication / SUMOylation of chromatin organization proteins / TICAM1, RIP1-mediated IKK complex recruitment / ubiquitin ligase complex / SUMOylation of DNA damage response and repair proteins / epigenetic regulation of gene expression / Packaging Of Telomere Ends / Recognition and association of DNA glycosylase with site containing an affected purine / Cleavage of the damaged purine / Deposition of new CENPA-containing nucleosomes at the centromere / Recognition and association of DNA glycosylase with site containing an affected pyrimidine / Cleavage of the damaged pyrimidine / Inhibition of DNA recombination at telomere / positive regulation of DNA repair / Meiotic synapsis / telomere organization / RNA Polymerase I Promoter Opening / Interleukin-7 signaling / Assembly of the ORC complex at the origin of replication / SUMOylation of chromatin organization proteins / TICAM1, RIP1-mediated IKK complex recruitment /  DNAメチル化 / IKK complex recruitment mediated by RIP1 / Condensation of Prophase Chromosomes / ERCC6 (CSB) and EHMT2 (G9a) positively regulate rRNA expression / Chromatin modifications during the maternal to zygotic transition (MZT) / SIRT1 negatively regulates rRNA expression / HCMV Late Events / DNAメチル化 / IKK complex recruitment mediated by RIP1 / Condensation of Prophase Chromosomes / ERCC6 (CSB) and EHMT2 (G9a) positively regulate rRNA expression / Chromatin modifications during the maternal to zygotic transition (MZT) / SIRT1 negatively regulates rRNA expression / HCMV Late Events /  innate immune response in mucosa / PRC2 methylates histones and DNA / innate immune response in mucosa / PRC2 methylates histones and DNA /  ubiquitin binding / Defective pyroptosis / Negative regulators of DDX58/IFIH1 signaling / HDACs deacetylate histones / ubiquitin binding / Defective pyroptosis / Negative regulators of DDX58/IFIH1 signaling / HDACs deacetylate histones /  Peroxisomal protein import / RNA Polymerase I Promoter Escape / Downregulation of SMAD2/3:SMAD4 transcriptional activity / Regulation of TNFR1 signaling / Peroxisomal protein import / RNA Polymerase I Promoter Escape / Downregulation of SMAD2/3:SMAD4 transcriptional activity / Regulation of TNFR1 signaling /  lipopolysaccharide binding / Nonhomologous End-Joining (NHEJ) / Transcriptional regulation by small RNAs / Formation of the beta-catenin:TCF transactivating complex / protein modification process / RUNX1 regulates genes involved in megakaryocyte differentiation and platelet function / RING-type E3 ubiquitin transferase / Activated PKN1 stimulates transcription of AR (androgen receptor) regulated genes KLK2 and KLK3 / NoRC negatively regulates rRNA expression / Oxygen-dependent proline hydroxylation of Hypoxia-inducible Factor Alpha / G2/M DNA damage checkpoint / Inactivation of CSF3 (G-CSF) signaling / HDMs demethylate histones / B-WICH complex positively regulates rRNA expression / DNA Damage/Telomere Stress Induced Senescence / Metalloprotease DUBs / PKMTs methylate histone lysines / RMTs methylate histone arginines / lipopolysaccharide binding / Nonhomologous End-Joining (NHEJ) / Transcriptional regulation by small RNAs / Formation of the beta-catenin:TCF transactivating complex / protein modification process / RUNX1 regulates genes involved in megakaryocyte differentiation and platelet function / RING-type E3 ubiquitin transferase / Activated PKN1 stimulates transcription of AR (androgen receptor) regulated genes KLK2 and KLK3 / NoRC negatively regulates rRNA expression / Oxygen-dependent proline hydroxylation of Hypoxia-inducible Factor Alpha / G2/M DNA damage checkpoint / Inactivation of CSF3 (G-CSF) signaling / HDMs demethylate histones / B-WICH complex positively regulates rRNA expression / DNA Damage/Telomere Stress Induced Senescence / Metalloprotease DUBs / PKMTs methylate histone lysines / RMTs methylate histone arginines /  遺伝的組換え / Pre-NOTCH Transcription and Translation / 遺伝的組換え / Pre-NOTCH Transcription and Translation /  nucleosome assembly / double-strand break repair via nonhomologous end joining / Activation of anterior HOX genes in hindbrain development during early embryogenesis / HCMV Early Events / protein polyubiquitination / Transcriptional regulation of granulopoiesis / ubiquitin-protein transferase activity / structural constituent of chromatin / UCH proteinases / nucleosome assembly / double-strand break repair via nonhomologous end joining / Activation of anterior HOX genes in hindbrain development during early embryogenesis / HCMV Early Events / protein polyubiquitination / Transcriptional regulation of granulopoiesis / ubiquitin-protein transferase activity / structural constituent of chromatin / UCH proteinases /  ubiquitin protein ligase activity / double-strand break repair / ubiquitin protein ligase activity / double-strand break repair /  ヌクレオソーム / antimicrobial humoral immune response mediated by antimicrobial peptide / Antigen processing: Ubiquitination & Proteasome degradation / E3 ubiquitin ligases ubiquitinate target proteins / Recruitment and ATM-mediated phosphorylation of repair and signaling proteins at DNA double strand breaks / site of double-strand break ヌクレオソーム / antimicrobial humoral immune response mediated by antimicrobial peptide / Antigen processing: Ubiquitination & Proteasome degradation / E3 ubiquitin ligases ubiquitinate target proteins / Recruitment and ATM-mediated phosphorylation of repair and signaling proteins at DNA double strand breaks / site of double-strand break類似検索 - 分子機能 | |||||||||
| 生物種 |   Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||
| 手法 |  単粒子再構成法 / 単粒子再構成法 /  クライオ電子顕微鏡法 / 解像度: 3.9 Å クライオ電子顕微鏡法 / 解像度: 3.9 Å | |||||||||
 データ登録者 データ登録者 | Hu Q / Botuyan MV / Zhao D / Cui G / Mer G | |||||||||
| 資金援助 |  米国, 2件 米国, 2件
| |||||||||
 引用 引用 |  ジャーナル: Mol Cell / 年: 2024 ジャーナル: Mol Cell / 年: 2024タイトル: Mechanisms of RNF168 nucleosome recognition and ubiquitylation. 著者: Qi Hu / Debiao Zhao / Gaofeng Cui / Janarjan Bhandari / James R Thompson / Maria Victoria Botuyan / Georges Mer /  要旨: RNF168 plays a central role in the DNA damage response (DDR) by ubiquitylating histone H2A at K13 and K15. These modifications direct BRCA1-BARD1 and 53BP1 foci formation in chromatin, essential for ...RNF168 plays a central role in the DNA damage response (DDR) by ubiquitylating histone H2A at K13 and K15. These modifications direct BRCA1-BARD1 and 53BP1 foci formation in chromatin, essential for cell-cycle-dependent DNA double-strand break (DSB) repair pathway selection. The mechanism by which RNF168 catalyzes the targeted accumulation of H2A ubiquitin conjugates to form repair foci around DSBs remains unclear. Here, using cryoelectron microscopy (cryo-EM), nuclear magnetic resonance (NMR) spectroscopy, and functional assays, we provide a molecular description of the reaction cycle and dynamics of RNF168 as it modifies the nucleosome and recognizes its ubiquitylation products. We demonstrate an interaction of a canonical ubiquitin-binding domain within full-length RNF168, which not only engages ubiquitin but also the nucleosome surface, clarifying how such site-specific ubiquitin recognition propels a signal amplification loop. Beyond offering mechanistic insights into a key DDR protein, our study aids in understanding site specificity in both generating and interpreting chromatin ubiquitylation. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_41801.map.gz emd_41801.map.gz | 4.8 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-41801-v30.xml emd-41801-v30.xml emd-41801.xml emd-41801.xml | 29 KB 29 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  emd_41801.png emd_41801.png | 157.4 KB | ||
| マスクデータ |  emd_41801_msk_1.map emd_41801_msk_1.map | 64 MB |  マスクマップ マスクマップ | |
| Filedesc metadata |  emd-41801.cif.gz emd-41801.cif.gz | 7.5 KB | ||
| その他 |  emd_41801_additional_1.map.gz emd_41801_additional_1.map.gz emd_41801_half_map_1.map.gz emd_41801_half_map_1.map.gz emd_41801_half_map_2.map.gz emd_41801_half_map_2.map.gz | 40.1 MB 49.8 MB 49.9 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-41801 http://ftp.pdbj.org/pub/emdb/structures/EMD-41801 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-41801 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-41801 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  8u14MC  8smwC  8smxC  8smyC  8smzC  8sn0C  8sn1C  8sn2C  8sn3C  8sn4C  8sn5C  8sn6C  8sn7C  8sn8C  8sn9C  8snaC  8txvC  8txwC  8txxC  8u13C  8upfC  8uq8C  8uq9C  8uqaC  8uqbC  8uqcC  8uqdC  8uqeC C: 同じ文献を引用 ( M: このマップから作成された原子モデル |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_41801.map.gz / 形式: CCP4 / 大きさ: 64 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_41801.map.gz / 形式: CCP4 / 大きさ: 64 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ボクセルのサイズ | X=Y=Z: 1.0276 Å | ||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-マスク #1
| ファイル |  emd_41801_msk_1.map emd_41801_msk_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
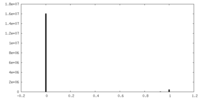
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-追加マップ: #1
| ファイル | emd_41801_additional_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
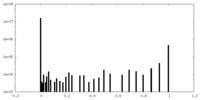
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: #1
| ファイル | emd_41801_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
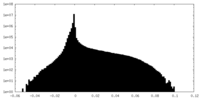
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: #2
| ファイル | emd_41801_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
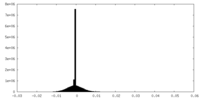
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
+全体 : Human nucleosome core particle ubiquitylated at histone H2A lysin...
+超分子 #1: Human nucleosome core particle ubiquitylated at histone H2A lysin...
+分子 #1: Histone H3.1
+分子 #2: Histone H4
+分子 #3: Histone H2B type 1-J
+分子 #6: E3 ubiquitin-protein ligase RNF168
+分子 #7: Ubiquitin-conjugating enzyme E2 D3
+分子 #8: Histone H2A type 1-B/E
+分子 #4: DNA (147-MER)
+分子 #5: DNA (146-MER)
+分子 #9: ZINC ION
-実験情報
-構造解析
| 手法 |  クライオ電子顕微鏡法 クライオ電子顕微鏡法 |
|---|---|
 解析 解析 |  単粒子再構成法 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 0.4 mg/mL |
|---|---|
| 緩衝液 | pH: 7.5 |
| グリッド | モデル: Quantifoil R1.2/1.3 / 材質: COPPER / 前処理 - タイプ: GLOW DISCHARGE / 前処理 - 時間: 60 sec. |
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 100 % / チャンバー内温度: 277 K / 装置: FEI VITROBOT MARK IV |
| 詳細 | 10 mM HEPES, 100 mM NaCl, 1 mM DTT, pH 7.5 |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD Bright-field microscopy / Cs: 2.7 mm / 最大 デフォーカス(公称値): 3.5 µm / 最小 デフォーカス(公称値): 1.0 µm / 倍率(公称値): 22500 Bright-field microscopy / Cs: 2.7 mm / 最大 デフォーカス(公称値): 3.5 µm / 最小 デフォーカス(公称値): 1.0 µm / 倍率(公称値): 22500 |
| 試料ステージ | 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER ホルダー冷却材: NITROGEN |
| 撮影 | フィルム・検出器のモデル: GATAN K3 BIOQUANTUM (6k x 4k) 撮影したグリッド数: 1 / 実像数: 5697 / 平均電子線量: 50.0 e/Å2 詳細: 5697 images were recorded in movie mode. 5503 were retained for particle picking. |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
- 画像解析
画像解析
| 粒子像選択 | 選択した数: 9989935 |
|---|---|
| 初期モデル | モデルのタイプ: NONE |
| 初期 角度割当 | タイプ: MAXIMUM LIKELIHOOD / ソフトウェア - 名称: cryoSPARC (ver. 4.1.1) |
| 最終 3次元分類 | クラス数: 3 / ソフトウェア - 名称: RELION (ver. 3.0.7) |
| 最終 角度割当 | タイプ: MAXIMUM LIKELIHOOD / ソフトウェア - 名称: cryoSPARC (ver. 4.1.1) |
| 最終 再構成 | アルゴリズム: FOURIER SPACE / 解像度のタイプ: BY AUTHOR / 解像度: 3.9 Å / 解像度の算出法: FSC 0.143 CUT-OFF / ソフトウェア - 名称: RELION (ver. 3.0.7) / 使用した粒子像数: 27986 |
-原子モデル構築 1
| 初期モデル |
| ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 精密化 | 空間: REAL / プロトコル: RIGID BODY FIT | ||||||||||||
| 得られたモデル |  PDB-8u14: |
 ムービー
ムービー コントローラー
コントローラー






































 Z
Z Y
Y X
X