+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
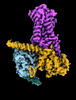
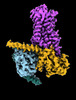
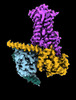
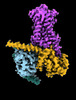
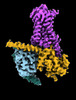
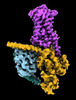
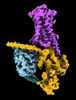
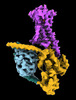
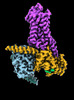
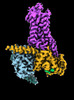
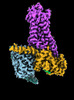
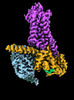
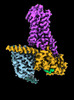
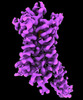
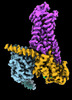
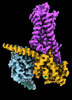
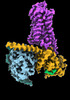
| タイトル | CryoEM structure of beta-2-adrenergic receptor in complex with Gs heterotrimer, 5 sec after GTP addition (#5 of 20) | |||||||||
 マップデータ マップデータ | Sharpened map | |||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード |  GPCR (Gタンパク質共役受容体) / GPCR (Gタンパク質共役受容体) /  Adrenergic / Receptor / Adrenergic / Receptor /  G protein (Gタンパク質) / G protein (Gタンパク質) /  SIGNALING PROTEIN SIGNALING PROTEIN | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報desensitization of G protein-coupled receptor signaling pathway by arrestin / beta2-adrenergic receptor activity / norepinephrine-epinephrine-mediated vasodilation involved in regulation of systemic arterial blood pressure / positive regulation of mini excitatory postsynaptic potential / positive regulation of cAMP-dependent protein kinase activity /  norepinephrine binding / norepinephrine binding /  アドレナリン受容体 / アドレナリン受容体 /  熱力学 / positive regulation of autophagosome maturation / positive regulation of AMPA receptor activity ...desensitization of G protein-coupled receptor signaling pathway by arrestin / beta2-adrenergic receptor activity / norepinephrine-epinephrine-mediated vasodilation involved in regulation of systemic arterial blood pressure / positive regulation of mini excitatory postsynaptic potential / positive regulation of cAMP-dependent protein kinase activity / 熱力学 / positive regulation of autophagosome maturation / positive regulation of AMPA receptor activity ...desensitization of G protein-coupled receptor signaling pathway by arrestin / beta2-adrenergic receptor activity / norepinephrine-epinephrine-mediated vasodilation involved in regulation of systemic arterial blood pressure / positive regulation of mini excitatory postsynaptic potential / positive regulation of cAMP-dependent protein kinase activity /  norepinephrine binding / norepinephrine binding /  アドレナリン受容体 / アドレナリン受容体 /  熱力学 / positive regulation of autophagosome maturation / positive regulation of AMPA receptor activity / activation of transmembrane receptor protein tyrosine kinase activity / negative regulation of smooth muscle contraction / positive regulation of lipophagy / response to psychosocial stress / negative regulation of multicellular organism growth / endosome to lysosome transport / adrenergic receptor signaling pathway / neuronal dense core vesicle / diet induced thermogenesis / positive regulation of protein kinase A signaling / 熱力学 / positive regulation of autophagosome maturation / positive regulation of AMPA receptor activity / activation of transmembrane receptor protein tyrosine kinase activity / negative regulation of smooth muscle contraction / positive regulation of lipophagy / response to psychosocial stress / negative regulation of multicellular organism growth / endosome to lysosome transport / adrenergic receptor signaling pathway / neuronal dense core vesicle / diet induced thermogenesis / positive regulation of protein kinase A signaling /  adenylate cyclase binding / smooth muscle contraction / potassium channel regulator activity / positive regulation of bone mineralization / adenylate cyclase-activating adrenergic receptor signaling pathway / brown fat cell differentiation / regulation of sodium ion transport / adenylate cyclase binding / smooth muscle contraction / potassium channel regulator activity / positive regulation of bone mineralization / adenylate cyclase-activating adrenergic receptor signaling pathway / brown fat cell differentiation / regulation of sodium ion transport /  bone resorption / activation of adenylate cyclase activity / response to cold / bone resorption / activation of adenylate cyclase activity / response to cold /  receptor-mediated endocytosis / Olfactory Signaling Pathway / clathrin-coated endocytic vesicle membrane / Activation of the phototransduction cascade / G beta:gamma signalling through PLC beta / Presynaptic function of Kainate receptors / Thromboxane signalling through TP receptor / adenylate cyclase-modulating G protein-coupled receptor signaling pathway / G-protein activation / G protein-coupled acetylcholine receptor signaling pathway / positive regulation of protein serine/threonine kinase activity / Activation of G protein gated Potassium channels / Inhibition of voltage gated Ca2+ channels via Gbeta/gamma subunits / Prostacyclin signalling through prostacyclin receptor / Glucagon signaling in metabolic regulation / G beta:gamma signalling through CDC42 / ADP signalling through P2Y purinoceptor 12 / G beta:gamma signalling through BTK / Synthesis, secretion, and inactivation of Glucagon-like Peptide-1 (GLP-1) / Sensory perception of sweet, bitter, and umami (glutamate) taste / photoreceptor disc membrane / Adrenaline,noradrenaline inhibits insulin secretion / Glucagon-type ligand receptors / Vasopressin regulates renal water homeostasis via Aquaporins / G alpha (z) signalling events / cellular response to catecholamine stimulus / Glucagon-like Peptide-1 (GLP1) regulates insulin secretion / ADORA2B mediated anti-inflammatory cytokines production / adenylate cyclase-activating dopamine receptor signaling pathway / ADP signalling through P2Y purinoceptor 1 / G beta:gamma signalling through PI3Kgamma / cellular response to prostaglandin E stimulus / Cooperation of PDCL (PhLP1) and TRiC/CCT in G-protein beta folding / sensory perception of taste / GPER1 signaling / cellular response to amyloid-beta / G-protein beta-subunit binding / Inactivation, recovery and regulation of the phototransduction cascade / receptor-mediated endocytosis / Olfactory Signaling Pathway / clathrin-coated endocytic vesicle membrane / Activation of the phototransduction cascade / G beta:gamma signalling through PLC beta / Presynaptic function of Kainate receptors / Thromboxane signalling through TP receptor / adenylate cyclase-modulating G protein-coupled receptor signaling pathway / G-protein activation / G protein-coupled acetylcholine receptor signaling pathway / positive regulation of protein serine/threonine kinase activity / Activation of G protein gated Potassium channels / Inhibition of voltage gated Ca2+ channels via Gbeta/gamma subunits / Prostacyclin signalling through prostacyclin receptor / Glucagon signaling in metabolic regulation / G beta:gamma signalling through CDC42 / ADP signalling through P2Y purinoceptor 12 / G beta:gamma signalling through BTK / Synthesis, secretion, and inactivation of Glucagon-like Peptide-1 (GLP-1) / Sensory perception of sweet, bitter, and umami (glutamate) taste / photoreceptor disc membrane / Adrenaline,noradrenaline inhibits insulin secretion / Glucagon-type ligand receptors / Vasopressin regulates renal water homeostasis via Aquaporins / G alpha (z) signalling events / cellular response to catecholamine stimulus / Glucagon-like Peptide-1 (GLP1) regulates insulin secretion / ADORA2B mediated anti-inflammatory cytokines production / adenylate cyclase-activating dopamine receptor signaling pathway / ADP signalling through P2Y purinoceptor 1 / G beta:gamma signalling through PI3Kgamma / cellular response to prostaglandin E stimulus / Cooperation of PDCL (PhLP1) and TRiC/CCT in G-protein beta folding / sensory perception of taste / GPER1 signaling / cellular response to amyloid-beta / G-protein beta-subunit binding / Inactivation, recovery and regulation of the phototransduction cascade /  heterotrimeric G-protein complex / G alpha (12/13) signalling events / heterotrimeric G-protein complex / G alpha (12/13) signalling events /  extracellular vesicle / signaling receptor complex adaptor activity / Thrombin signalling through proteinase activated receptors (PARs) / Cargo recognition for clathrin-mediated endocytosis / retina development in camera-type eye / extracellular vesicle / signaling receptor complex adaptor activity / Thrombin signalling through proteinase activated receptors (PARs) / Cargo recognition for clathrin-mediated endocytosis / retina development in camera-type eye /  GTPase binding / GTPase binding /  Clathrin-mediated endocytosis / Ca2+ pathway / phospholipase C-activating G protein-coupled receptor signaling pathway / positive regulation of cold-induced thermogenesis / Clathrin-mediated endocytosis / Ca2+ pathway / phospholipase C-activating G protein-coupled receptor signaling pathway / positive regulation of cold-induced thermogenesis /  amyloid-beta binding / G alpha (i) signalling events / fibroblast proliferation / G alpha (s) signalling events / G alpha (q) signalling events / Ras protein signal transduction / cell population proliferation / Extra-nuclear estrogen signaling / transcription by RNA polymerase II / positive regulation of MAPK cascade / amyloid-beta binding / G alpha (i) signalling events / fibroblast proliferation / G alpha (s) signalling events / G alpha (q) signalling events / Ras protein signal transduction / cell population proliferation / Extra-nuclear estrogen signaling / transcription by RNA polymerase II / positive regulation of MAPK cascade /  リソソーム / cell surface receptor signaling pathway / リソソーム / cell surface receptor signaling pathway /  receptor complex / receptor complex /  エンドソーム / endosome membrane / Ub-specific processing proteases / エンドソーム / endosome membrane / Ub-specific processing proteases /  エンドソーム / apical plasma membrane / G protein-coupled receptor signaling pathway / lysosomal membrane エンドソーム / apical plasma membrane / G protein-coupled receptor signaling pathway / lysosomal membrane類似検索 - 分子機能 | |||||||||
| 生物種 |   Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||
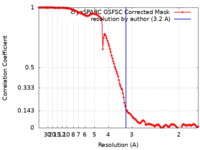
| 手法 |  単粒子再構成法 / 単粒子再構成法 /  クライオ電子顕微鏡法 / 解像度: 3.2 Å クライオ電子顕微鏡法 / 解像度: 3.2 Å | |||||||||
 データ登録者 データ登録者 | Papasergi-Scott MM / Skiniotis G | |||||||||
| 資金援助 |  米国, 1件 米国, 1件
| |||||||||
 引用 引用 |  ジャーナル: Nature / 年: 2024 ジャーナル: Nature / 年: 2024タイトル: Time-resolved cryo-EM of G-protein activation by a GPCR. 著者: Makaía M Papasergi-Scott / Guillermo Pérez-Hernández / Hossein Batebi / Yang Gao / Gözde Eskici / Alpay B Seven / Ouliana Panova / Daniel Hilger / Marina Casiraghi / Feng He / Luis Maul / ...著者: Makaía M Papasergi-Scott / Guillermo Pérez-Hernández / Hossein Batebi / Yang Gao / Gözde Eskici / Alpay B Seven / Ouliana Panova / Daniel Hilger / Marina Casiraghi / Feng He / Luis Maul / Peter Gmeiner / Brian K Kobilka / Peter W Hildebrand / Georgios Skiniotis /    要旨: G-protein-coupled receptors (GPCRs) activate heterotrimeric G proteins by stimulating guanine nucleotide exchange in the Gα subunit. To visualize this mechanism, we developed a time-resolved cryo-EM ...G-protein-coupled receptors (GPCRs) activate heterotrimeric G proteins by stimulating guanine nucleotide exchange in the Gα subunit. To visualize this mechanism, we developed a time-resolved cryo-EM approach that examines the progression of ensembles of pre-steady-state intermediates of a GPCR-G-protein complex. By monitoring the transitions of the stimulatory G protein in complex with the β-adrenergic receptor at short sequential time points after GTP addition, we identified the conformational trajectory underlying G-protein activation and functional dissociation from the receptor. Twenty structures generated from sequential overlapping particle subsets along this trajectory, compared to control structures, provide a high-resolution description of the order of main events driving G-protein activation in response to GTP binding. Structural changes propagate from the nucleotide-binding pocket and extend through the GTPase domain, enacting alterations to Gα switch regions and the α5 helix that weaken the G-protein-receptor interface. Molecular dynamics simulations with late structures in the cryo-EM trajectory support that enhanced ordering of GTP on closure of the α-helical domain against the nucleotide-bound Ras-homology domain correlates with α5 helix destabilization and eventual dissociation of the G protein from the GPCR. These findings also highlight the potential of time-resolved cryo-EM as a tool for mechanistic dissection of GPCR signalling events. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
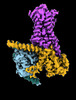
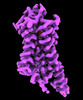
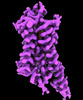
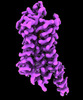
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_40100.map.gz emd_40100.map.gz | 230.3 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-40100-v30.xml emd-40100-v30.xml emd-40100.xml emd-40100.xml | 20.3 KB 20.3 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_40100_fsc.xml emd_40100_fsc.xml | 13.2 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_40100.png emd_40100.png | 107.9 KB | ||
| マスクデータ |  emd_40100_msk_1.map emd_40100_msk_1.map | 244.1 MB |  マスクマップ マスクマップ | |
| Filedesc metadata |  emd-40100.cif.gz emd-40100.cif.gz | 6.1 KB | ||
| その他 |  emd_40100_additional_1.map.gz emd_40100_additional_1.map.gz emd_40100_half_map_1.map.gz emd_40100_half_map_1.map.gz emd_40100_half_map_2.map.gz emd_40100_half_map_2.map.gz | 122.3 MB 226.8 MB 226.8 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-40100 http://ftp.pdbj.org/pub/emdb/structures/EMD-40100 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-40100 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-40100 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  8gdzC  8ge1C  8ge2C  8ge3C  8ge4C  8ge5C  8ge6C  8ge7C  8ge8C  8ge9C  8geaC  8gebC  8gecC  8gedC  8geeC  8gefC  8gegC  8gehC  8geiC  8gejC  8gfvC  8gfwC  8gfxC  8gfyC  8gfzC  8gg0C  8gg1C  8gg2C  8gg3C  8gg4C  8gg5C  8gg6C  8gg7C  8gg8C  8gg9C  8ggaC  8ggbC  8ggcC  8ggeC  8ggfC  8ggiC  8ggjC  8ggkC  8gglC  8ggmC  8ggnC  8ggoC  8ggpC  8ggqC  8ggrC  8ggsC  8ggtC  8gguC  8ggvC  8ggwC  8ggxC  8ggyC  8ggzC  8gh0C  8gh1C  8unlC  8unmC  8unnC  8unoC  8unpC  8unqC  8unrC  8unsC  8untC  8unuC  8unvC  8unwC  8unxC  8unyC  8unzC  8uo0C  8uo1C  8uo2C  8uo3C  8uo4C C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_40100.map.gz / 形式: CCP4 / 大きさ: 244.1 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_40100.map.gz / 形式: CCP4 / 大きさ: 244.1 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Sharpened map | ||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 0.8677 Å | ||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-マスク #1
| ファイル |  emd_40100_msk_1.map emd_40100_msk_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-追加マップ: Unsharpened map
| ファイル | emd_40100_additional_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Unsharpened map | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: Half map
| ファイル | emd_40100_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Half map | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: Half map
| ファイル | emd_40100_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Half map | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : Complex of beta-2 adrenergic receptor and Gs heterotrimer, 5 sec ...
| 全体 | 名称: Complex of beta-2 adrenergic receptor and Gs heterotrimer, 5 sec post GTP treatment |
|---|---|
| 要素 |
|
-超分子 #1: Complex of beta-2 adrenergic receptor and Gs heterotrimer, 5 sec ...
| 超分子 | 名称: Complex of beta-2 adrenergic receptor and Gs heterotrimer, 5 sec post GTP treatment タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: all |
|---|---|
| 由来(天然) | 生物種:   Homo sapiens (ヒト) Homo sapiens (ヒト) |
-分子 #1: G protein alpha s (short)
| 分子 | 名称: G protein alpha s (short) / タイプ: protein_or_peptide / ID: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:   Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 配列 | 文字列: MGCLGNSKTE DQRNEEKAQR EANKKIEKQL QKDKQVYRAT HRLLLLGAGE SGKSTIVKQM RILHVNGFNG DSEKATKVQD IKNNLKEAIE TIVAAMSNLV PPVELANPEN QFRVDYILSV MNVPDFDFPP EFYEHAKALW EDEGVRACYE RSNEYQLIDC AQYFLDKIDV ...文字列: MGCLGNSKTE DQRNEEKAQR EANKKIEKQL QKDKQVYRAT HRLLLLGAGE SGKSTIVKQM RILHVNGFNG DSEKATKVQD IKNNLKEAIE TIVAAMSNLV PPVELANPEN QFRVDYILSV MNVPDFDFPP EFYEHAKALW EDEGVRACYE RSNEYQLIDC AQYFLDKIDV IKQADYVPSD QDLLRCRVLT SGIFETKFQV DKVNFHMFDV GGQRDERRKW IQCFNDVTAI IFVVASSSYN MVIREDNQTN RLQEALNLFK SIWNNRWLRT ISVILFLNKQ DLLAEKVLAG KSKIEDYFPE FARYTTPEDA TPEPGEDPRV TRAKYFIRDE FLRISTASGD GRHYCYPHFT CAVDTENIRR VFNDCRDIIQ RMHLRQYELL UniProtKB: Isoform Gnas-2 of Guanine nucleotide-binding protein G(s) subunit alpha isoforms short |
-分子 #2: G protein beta 1
| 分子 | 名称: G protein beta 1 / タイプ: protein_or_peptide / ID: 2 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:   Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 配列 | 文字列: GSSGSELDQL RQEAEQLKNQ IRDARKACAD ATLSQITNNI DPVGRIQMRT RRTLRGHLAK IYAMHWGTDS RLLVSASQDG KLIIWDSYTT NKVHAIPLRS SWVMTCAYAP SGNYVACGGL DNICSIYNLK TREGNVRVSR ELAGHTGYLS CCRFLDDNQI VTSSGDTTCA ...文字列: GSSGSELDQL RQEAEQLKNQ IRDARKACAD ATLSQITNNI DPVGRIQMRT RRTLRGHLAK IYAMHWGTDS RLLVSASQDG KLIIWDSYTT NKVHAIPLRS SWVMTCAYAP SGNYVACGGL DNICSIYNLK TREGNVRVSR ELAGHTGYLS CCRFLDDNQI VTSSGDTTCA LWDIETGQQT TTFTGHTGDV MSLSLAPDTR LFVSGACDAS AKLWDVREGM CRQTFTGHES DINAICFFPN GNAFATGSDD ATCRLFDLRA DQELMTYSHD NIICGITSVS FSKSGRLLLA GYDDFNCNVW DALKADRAGV LAGHDNRVSC LGVTDDGMAV ATGSWDSFLK IWN UniProtKB: Guanine nucleotide-binding protein G(I)/G(S)/G(T) subunit beta-1 |
-分子 #3: G protein gamma 2
| 分子 | 名称: G protein gamma 2 / タイプ: protein_or_peptide / ID: 3 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:   Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 配列 | 文字列: MASNNTASIA QARKLVEQLK MEANIDRIKV SKAAADLMAY CEAHAKEDPL LTPVPASENP FREKKFFCAI L UniProtKB: Guanine nucleotide-binding protein G(I)/G(S)/G(O) subunit gamma-2 |
-分子 #4: Beta-2 adrenergic receptor
| 分子 | 名称: Beta-2 adrenergic receptor / タイプ: protein_or_peptide / ID: 4 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:   Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 配列 | 文字列: MKTIIALSYI FCLVFADYKD DDDAMGQPGN GSAFLLAPNR SHAPDHDVEN LYFQGTQQRD EVWVVGMGIV MSLIVLAIVF GNVLVITAIA KFERLQTVTN YFITSLACAD LVMGLAVVPF GAAHILTKTW TFGNFWCEFW TSIDVLCVTA SIETLCVIAV DRYFAITSPF ...文字列: MKTIIALSYI FCLVFADYKD DDDAMGQPGN GSAFLLAPNR SHAPDHDVEN LYFQGTQQRD EVWVVGMGIV MSLIVLAIVF GNVLVITAIA KFERLQTVTN YFITSLACAD LVMGLAVVPF GAAHILTKTW TFGNFWCEFW TSIDVLCVTA SIETLCVIAV DRYFAITSPF KYQSLLTKNK ARVIILMVWI VSGLTSFLPI QMHWYRATHQ EAINCYAEET CCDFFTNQAY AIASSIVSFY VPLVIMVFVY SRVFQEAKRQ LQKIDKSEGR FHVQNLSQVE QDGRTGHGLR RSSKFCLKEH KALKTLGIIM GTFTLCWLPF FIVNIVHVIQ DNLIRKEVYI LLNWIGYVNS GFNPLIYCRS PDFRIAFQEL LCLRRSSLKA YGNGYSSNGN TGEQSGLEVL FQGPYHVEQE KENKLLAEDL PGTEDFVGHQ GTVPSDNIDS QGRNASTNDS LLETSQVAPA UniProtKB:  Beta-2 adrenergic receptor Beta-2 adrenergic receptor |
-実験情報
-構造解析
| 手法 |  クライオ電子顕微鏡法 クライオ電子顕微鏡法 |
|---|---|
 解析 解析 |  単粒子再構成法 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 緩衝液 | pH: 7.5 |
|---|---|
| グリッド | モデル: UltrAuFoil R1.2/1.3 / 支持フィルム - 材質: GOLD / 支持フィルム - トポロジー: HOLEY / 前処理 - タイプ: GLOW DISCHARGE |
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 100 % / 装置: FEI VITROBOT MARK IV |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD Bright-field microscopy / 最大 デフォーカス(公称値): 2.0 µm / 最小 デフォーカス(公称値): 1.0 µm Bright-field microscopy / 最大 デフォーカス(公称値): 2.0 µm / 最小 デフォーカス(公称値): 1.0 µm |
| 試料ステージ | 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER ホルダー冷却材: NITROGEN |
| 撮影 | フィルム・検出器のモデル: GATAN K3 (6k x 4k) / 検出モード: COUNTING / 平均電子線量: 60.48 e/Å2 |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
 ムービー
ムービー コントローラー
コントローラー



































































































































































 Z
Z Y
Y X
X