+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Cryo-EM structure of hAQP2 in DDM | |||||||||
 マップデータ マップデータ | ||||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | channel /  MEMBRANE PROTEIN (膜タンパク質) MEMBRANE PROTEIN (膜タンパク質) | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報cellular response to water deprivation / renal water transport / glycerol transmembrane transporter activity / Passive transport by Aquaporins / glycerol transmembrane transport / lumenal side of membrane / water transmembrane transporter activity / cellular response to mercury ion /  water channel activity / water transport ...cellular response to water deprivation / renal water transport / glycerol transmembrane transporter activity / Passive transport by Aquaporins / glycerol transmembrane transport / lumenal side of membrane / water transmembrane transporter activity / cellular response to mercury ion / water channel activity / water transport ...cellular response to water deprivation / renal water transport / glycerol transmembrane transporter activity / Passive transport by Aquaporins / glycerol transmembrane transport / lumenal side of membrane / water transmembrane transporter activity / cellular response to mercury ion /  water channel activity / water transport / metanephric collecting duct development / renal water homeostasis / transport vesicle membrane / cellular response to copper ion / actin filament organization / recycling endosome / Vasopressin regulates renal water homeostasis via Aquaporins / basolateral plasma membrane / protein homotetramerization / apical plasma membrane / perinuclear region of cytoplasm / water channel activity / water transport / metanephric collecting duct development / renal water homeostasis / transport vesicle membrane / cellular response to copper ion / actin filament organization / recycling endosome / Vasopressin regulates renal water homeostasis via Aquaporins / basolateral plasma membrane / protein homotetramerization / apical plasma membrane / perinuclear region of cytoplasm /  ゴルジ体 / extracellular exosome / ゴルジ体 / extracellular exosome /  生体膜 / 生体膜 /  細胞膜 細胞膜類似検索 - 分子機能 | |||||||||
| 生物種 |   Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||
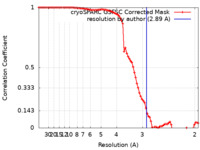
| 手法 |  単粒子再構成法 / 単粒子再構成法 /  クライオ電子顕微鏡法 / 解像度: 2.89 Å クライオ電子顕微鏡法 / 解像度: 2.89 Å | |||||||||
 データ登録者 データ登録者 | Kamegawa A / Suzuki S / Nishikawa K / Numoto N / Suzuki H / Fujiyoshi Y | |||||||||
| 資金援助 |  日本, 1件 日本, 1件
| |||||||||
 引用 引用 |  ジャーナル: J Struct Biol / 年: 2023 ジャーナル: J Struct Biol / 年: 2023タイトル: Structural analysis of the water channel AQP2 by single-particle cryo-EM. 著者: Akiko Kamegawa / Shota Suzuki / Hiroshi Suzuki / Kouki Nishikawa / Nobutaka Numoto / Yoshinori Fujiyoshi /  要旨: Water channels, which are small membrane proteins almost entirely buried in lipid membranes, are challenging research targets for single-particle cryo-electron microscopy (cryo-EM), a powerful ...Water channels, which are small membrane proteins almost entirely buried in lipid membranes, are challenging research targets for single-particle cryo-electron microscopy (cryo-EM), a powerful technique routinely used to determine the structures of membrane proteins. Because the single-particle method enables structural analysis of a whole protein with flexible parts that interfere with crystallization, we have focused our efforts on analyzing water channel structures. Here, utilizing this system, we analyzed the structure of full-length aquaporin-2 (AQP2), a primary regulator of vasopressin-dependent reabsorption of water at the renal collecting ducts. The 2.9 Å resolution map revealed a cytoplasmic extension of the cryo-EM density that was presumed to be the highly flexible C-terminus at which the localization of AQP2 is regulated in the renal collecting duct cells. We also observed a continuous density along the common water pathway inside the channel pore and lipid-like molecules at the membrane interface. Observations of these constructions in the AQP2 structure analyzed without any fiducial markers (e.g., a rigidly bound antibody) indicate that single-particle cryo-EM will be useful for investigating water channels in native states as well as in complexes with chemical compounds. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_29934.map.gz emd_29934.map.gz | 3.9 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-29934-v30.xml emd-29934-v30.xml emd-29934.xml emd-29934.xml | 13.9 KB 13.9 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_29934_fsc.xml emd_29934_fsc.xml | 8.4 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_29934.png emd_29934.png | 57.8 KB | ||
| マスクデータ |  emd_29934_msk_1.map emd_29934_msk_1.map | 4.3 MB |  マスクマップ マスクマップ | |
| その他 |  emd_29934_half_map_1.map.gz emd_29934_half_map_1.map.gz emd_29934_half_map_2.map.gz emd_29934_half_map_2.map.gz | 3.8 MB 3.8 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-29934 http://ftp.pdbj.org/pub/emdb/structures/EMD-29934 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-29934 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-29934 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  8gclMC M: このマップから作成された原子モデル C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_29934.map.gz / 形式: CCP4 / 大きさ: 4.3 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_29934.map.gz / 形式: CCP4 / 大きさ: 4.3 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ボクセルのサイズ | X=Y=Z: 0.96 Å | ||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-マスク #1
| ファイル |  emd_29934_msk_1.map emd_29934_msk_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: #2
| ファイル | emd_29934_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: #1
| ファイル | emd_29934_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : tetrameter of hAQP2
| 全体 | 名称: tetrameter of hAQP2 |
|---|---|
| 要素 |
|
-超分子 #1: tetrameter of hAQP2
| 超分子 | 名称: tetrameter of hAQP2 / タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: all |
|---|---|
| 由来(天然) | 生物種:   Homo sapiens (ヒト) Homo sapiens (ヒト) |
-分子 #1: Aquaporin-2
| 分子 | 名称: Aquaporin-2 / タイプ: protein_or_peptide / ID: 1 / コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:   Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 28.862389 KDa |
| 組換発現 | 生物種:   Spodoptera frugiperda (ツマジロクサヨトウ) Spodoptera frugiperda (ツマジロクサヨトウ) |
| 配列 | 文字列: MWELRSIAFS RAVFAEFLAT LLFVFFGLGS ALNWPQALPS VLQIAMAFGL GIGTLVQALG HISGAHINPA VTVACLVGCH VSVLRAAFY VAAQLLGAVA GAALLHEITP ADIRGDLAVN ALSNSTTAGQ AVTVELFLTL QLVLCIFAST DERRGENPGT P ALSIGFSV ...文字列: MWELRSIAFS RAVFAEFLAT LLFVFFGLGS ALNWPQALPS VLQIAMAFGL GIGTLVQALG HISGAHINPA VTVACLVGCH VSVLRAAFY VAAQLLGAVA GAALLHEITP ADIRGDLAVN ALSNSTTAGQ AVTVELFLTL QLVLCIFAST DERRGENPGT P ALSIGFSV ALGHLLGIHY TGCSMNPARS LAPAVVTGKF DDHWVFWIGP LVGAILGSLL YNYVLFPPAK SLSERLAVLK GL EPDTDWE EREVRRRQSV ELHSPQSLPR GTKA |
-実験情報
-構造解析
| 手法 |  クライオ電子顕微鏡法 クライオ電子顕微鏡法 |
|---|---|
 解析 解析 |  単粒子再構成法 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 7.2 mg/mL |
|---|---|
| 緩衝液 | pH: 8 |
| グリッド | モデル: Quantifoil R1.2/1.3 / 材質: MOLYBDENUM / メッシュ: 200 / 前処理 - タイプ: GLOW DISCHARGE / 前処理 - 時間: 30 sec. |
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 100 % / チャンバー内温度: 295 K |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | JEOL CRYO ARM 300 |
|---|---|
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD Bright-field microscopy / 最大 デフォーカス(公称値): 2.5 µm / 最小 デフォーカス(公称値): 1.2 µm Bright-field microscopy / 最大 デフォーカス(公称値): 2.5 µm / 最小 デフォーカス(公称値): 1.2 µm |
| 撮影 | フィルム・検出器のモデル: GATAN K2 SUMMIT (4k x 4k) 検出モード: COUNTING / 平均電子線量: 69.6 e/Å2 |
 ムービー
ムービー コントローラー
コントローラー






 Z
Z Y
Y X
X