+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-2761 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Structural Basis of Human Parechovirus Neutralization by Human Monoclonal Antibodies | |||||||||
 マップデータ マップデータ | Reconstruction of human parechovirus 1 in complex with Fab fragments of AM28 human monoclonal antibody | |||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード |  Human parechovirus 1 / AM28 / Human parechovirus 1 / AM28 /  human monoclonal antibody (モノクローナル抗体) / HPeV1-AM28 Fab human monoclonal antibody (モノクローナル抗体) / HPeV1-AM28 Fab | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報host cell nucleolus / host cell Golgi membrane / ribonucleoside triphosphate phosphatase activity /  picornain 3C / T=pseudo3 icosahedral viral capsid / host cell cytoplasmic vesicle membrane / picornain 3C / T=pseudo3 icosahedral viral capsid / host cell cytoplasmic vesicle membrane /  : / nucleoside-triphosphate phosphatase / protein complex oligomerization / monoatomic ion channel activity ...host cell nucleolus / host cell Golgi membrane / ribonucleoside triphosphate phosphatase activity / : / nucleoside-triphosphate phosphatase / protein complex oligomerization / monoatomic ion channel activity ...host cell nucleolus / host cell Golgi membrane / ribonucleoside triphosphate phosphatase activity /  picornain 3C / T=pseudo3 icosahedral viral capsid / host cell cytoplasmic vesicle membrane / picornain 3C / T=pseudo3 icosahedral viral capsid / host cell cytoplasmic vesicle membrane /  : / nucleoside-triphosphate phosphatase / protein complex oligomerization / monoatomic ion channel activity / clathrin-dependent endocytosis of virus by host cell / : / nucleoside-triphosphate phosphatase / protein complex oligomerization / monoatomic ion channel activity / clathrin-dependent endocytosis of virus by host cell /  RNA helicase activity / host cell endoplasmic reticulum membrane / induction by virus of host autophagy / RNA helicase activity / host cell endoplasmic reticulum membrane / induction by virus of host autophagy /  RNA依存性RNAポリメラーゼ / viral RNA genome replication / cysteine-type endopeptidase activity / RNA依存性RNAポリメラーゼ / viral RNA genome replication / cysteine-type endopeptidase activity /  RNA-dependent RNA polymerase activity / DNA-templated transcription / virion attachment to host cell / structural molecule activity / RNA-dependent RNA polymerase activity / DNA-templated transcription / virion attachment to host cell / structural molecule activity /  タンパク質分解 / タンパク質分解 /  RNA binding / RNA binding /  ATP binding / ATP binding /  生体膜 / 生体膜 /  metal ion binding metal ion binding類似検索 - 分子機能 | |||||||||
| 生物種 |   Homo sapiens (ヒト) / Homo sapiens (ヒト) /   Human parechovirus 1 (ウイルス) Human parechovirus 1 (ウイルス) | |||||||||
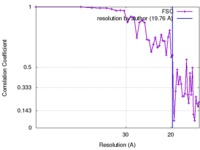
| 手法 |  単粒子再構成法 / 単粒子再構成法 /  クライオ電子顕微鏡法 / 解像度: 19.76 Å クライオ電子顕微鏡法 / 解像度: 19.76 Å | |||||||||
 データ登録者 データ登録者 | Shakeel S / Westerhuis BM / Ora A / Koen G / Bakker A / Claassen Y / Beaumont T / Wolthers K / Butcher SJ | |||||||||
 引用 引用 |  ジャーナル: J Virol / 年: 2015 ジャーナル: J Virol / 年: 2015タイトル: Structural Basis of Human Parechovirus Neutralization by Human Monoclonal Antibodies. 著者: Shabih Shakeel / Brenda M Westerhuis / Ari Ora / Gerrit Koen / Arjen Q Bakker / Yvonne Claassen / Koen Wagner / Tim Beaumont / Katja C Wolthers / Sarah J Butcher /   要旨: Since it was first recognized in 2004 that human parechoviruses (HPeV) are a significant cause of central nervous system and neonatal sepsis, their clinical importance, primarily in children, has ...Since it was first recognized in 2004 that human parechoviruses (HPeV) are a significant cause of central nervous system and neonatal sepsis, their clinical importance, primarily in children, has started to emerge. Intravenous immunoglobulin treatment is the only treatment available in such life-threatening cases and has given moderate success. Direct inhibition of parechovirus infection using monoclonal antibodies is a potential treatment. We have developed two neutralizing monoclonal antibodies against HPeV1 and HPeV2, namely, AM18 and AM28, which also cross-neutralize other viruses. Here, we present the mapping of their epitopes using peptide scanning, surface plasmon resonance, fluorescence-based thermal shift assays, electron cryomicroscopy, and image reconstruction. We determined by peptide scanning and surface plasmon resonance that AM18 recognizes a linear epitope motif including the arginine-glycine-aspartic acid on the C terminus of capsid protein VP1. This epitope is normally used by the virus to attach to host cell surface integrins during entry and is found in 3 other viruses that AM18 neutralizes. Therefore, AM18 is likely to cause virus neutralization by aggregation and by blocking integrin binding to the capsid. Further, we show by electron cryomicroscopy, three-dimensional reconstruction, and pseudoatomic model fitting that ordered RNA interacts with HPeV1 VP1 and VP3. AM28 recognizes quaternary epitopes on the capsid composed of VP0 and VP3 loops from neighboring pentamers, thereby increasing the RNA accessibility temperature for the virus-AM28 complex compared to the virus alone. Thus, inhibition of RNA uncoating probably contributes to neutralization by AM28. IMPORTANCE: Human parechoviruses can cause mild infections to severe diseases in young children, such as neonatal sepsis, encephalitis, and cardiomyopathy. Intravenous immunoglobulin treatment is the ...IMPORTANCE: Human parechoviruses can cause mild infections to severe diseases in young children, such as neonatal sepsis, encephalitis, and cardiomyopathy. Intravenous immunoglobulin treatment is the only treatment available in such life-threatening cases. In order to develop more targeted treatment, we have searched for human monoclonal antibodies that would neutralize human parechoviruses 1 and 2, associated with mild infections such as gastroenteritis and severe infections of the central nervous system, and thus allow safe treatment. In the current study, we show how two such promising antibodies interact with the virus, modeling the atomic interactions between the virus and the antibody to propose how neutralization occurs. Both antibodies can cause aggregation; in addition, one antibody interferes with the virus recognizing its target cell, while the other, recognizing only the whole virus, inhibits the genome uncoating and replication in the cell. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_2761.map.gz emd_2761.map.gz | 7.4 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-2761-v30.xml emd-2761-v30.xml emd-2761.xml emd-2761.xml | 9.7 KB 9.7 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_2761_fsc.xml emd_2761_fsc.xml | 3.7 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  EMD-2761.jpg EMD-2761.jpg emd_2761.jpg emd_2761.jpg | 37.4 KB 37.4 KB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-2761 http://ftp.pdbj.org/pub/emdb/structures/EMD-2761 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-2761 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-2761 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_2761.map.gz / 形式: CCP4 / 大きさ: 15.1 MB / タイプ: IMAGE STORED AS SIGNED INTEGER (2 BYTES) ダウンロード / ファイル: emd_2761.map.gz / 形式: CCP4 / 大きさ: 15.1 MB / タイプ: IMAGE STORED AS SIGNED INTEGER (2 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Reconstruction of human parechovirus 1 in complex with Fab fragments of AM28 human monoclonal antibody | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 2.17 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
- 試料の構成要素
試料の構成要素
-全体 : Human parechovirus in complex with Fab fragment of human monoclon...
| 全体 | 名称: Human parechovirus in complex with Fab fragment of human monoclonal antibody AM28 |
|---|---|
| 要素 |
|
-超分子 #1000: Human parechovirus in complex with Fab fragment of human monoclon...
| 超分子 | 名称: Human parechovirus in complex with Fab fragment of human monoclonal antibody AM28 タイプ: sample / ID: 1000 / Number unique components: 2 |
|---|
-超分子 #1: Human parechovirus 1
| 超分子 | 名称: Human parechovirus 1 / タイプ: virus / ID: 1 / Name.synonym: HPeV1 詳細: Fab fragments of human monoclonal antibody, AM28 were attached to the virus NCBI-ID: 12063 / 生物種: Human parechovirus 1 / Sci species strain: 1 / ウイルスタイプ: VIRION / ウイルス・単離状態: STRAIN / ウイルス・エンベロープ: No / ウイルス・中空状態: No / Syn species name: HPeV1 |
|---|---|
| 宿主 | 生物種:   Homo sapiens (ヒト) / 別称: VERTEBRATES Homo sapiens (ヒト) / 別称: VERTEBRATES |
-分子 #1: human monoclonal antibody
| 分子 | 名称: human monoclonal antibody / タイプ: protein_or_peptide / ID: 1 / Name.synonym: AM28 詳細: Fab fragments of human monoclonal antibody, AM28 were attached to the virus コピー数: 60 / 組換発現: Yes |
|---|---|
| 由来(天然) | 生物種:   Homo sapiens (ヒト) / 別称: Human Homo sapiens (ヒト) / 別称: Human |
| 組換発現 | 生物種:   Homo sapiens (ヒト) / 組換細胞: 293T cells Homo sapiens (ヒト) / 組換細胞: 293T cells |
-実験情報
-構造解析
| 手法 |  クライオ電子顕微鏡法 クライオ電子顕微鏡法 |
|---|---|
 解析 解析 |  単粒子再構成法 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 緩衝液 | pH: 7.5 / 詳細: 10 mM Tris-HCl, pH 7.5, 150 mM NaCl, 1 mM MgCl2 |
|---|---|
| 凍結 | 凍結剤: ETHANE / 装置: HOMEMADE PLUNGER |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TECNAI F20 |
|---|---|
| 電子線 | 加速電圧: 200 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD Bright-field microscopy / Cs: 2 mm / 最大 デフォーカス(公称値): 4.06 µm / 最小 デフォーカス(公称値): 1.65 µm / 倍率(公称値): 69000 Bright-field microscopy / Cs: 2 mm / 最大 デフォーカス(公称値): 4.06 µm / 最小 デフォーカス(公称値): 1.65 µm / 倍率(公称値): 69000 |
| 試料ステージ | 試料ホルダーモデル: GATAN LIQUID NITROGEN |
| 日付 | 2013年2月1日 |
| 撮影 | カテゴリ: CCD フィルム・検出器のモデル: GATAN ULTRASCAN 4000 (4k x 4k) デジタル化 - サンプリング間隔: 15 µm / 実像数: 65 |
| 実験機器 |  モデル: Tecnai F20 / 画像提供: FEI Company |
 ムービー
ムービー コントローラー
コントローラー