+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Full-length human cystathionine beta-synthase, basal state, single particle reconstruction | |||||||||
 マップデータ マップデータ | ||||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード |  Filament / Filament /  Allostery (アロステリック効果) / Allostery (アロステリック効果) /  TRANSFERASE (転移酵素) TRANSFERASE (転移酵素) | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報Cysteine formation from homocysteine / homocysteine catabolic process / modified amino acid binding /  cystathionine beta-synthase / cystathionine beta-synthase /  cystathionine beta-synthase activity / cysteine biosynthetic process via cystathionine / Metabolism of ingested SeMet, Sec, MeSec into H2Se / homocysteine metabolic process / L-serine catabolic process / cystathionine beta-synthase activity / cysteine biosynthetic process via cystathionine / Metabolism of ingested SeMet, Sec, MeSec into H2Se / homocysteine metabolic process / L-serine catabolic process /  carbon monoxide binding ...Cysteine formation from homocysteine / homocysteine catabolic process / modified amino acid binding / carbon monoxide binding ...Cysteine formation from homocysteine / homocysteine catabolic process / modified amino acid binding /  cystathionine beta-synthase / cystathionine beta-synthase /  cystathionine beta-synthase activity / cysteine biosynthetic process via cystathionine / Metabolism of ingested SeMet, Sec, MeSec into H2Se / homocysteine metabolic process / L-serine catabolic process / cystathionine beta-synthase activity / cysteine biosynthetic process via cystathionine / Metabolism of ingested SeMet, Sec, MeSec into H2Se / homocysteine metabolic process / L-serine catabolic process /  carbon monoxide binding / hydrogen sulfide biosynthetic process / L-serine metabolic process / cartilage development involved in endochondral bone morphogenesis / regulation of nitric oxide mediated signal transduction / cysteine biosynthetic process / L-cysteine catabolic process / cerebellum morphogenesis / carbon monoxide binding / hydrogen sulfide biosynthetic process / L-serine metabolic process / cartilage development involved in endochondral bone morphogenesis / regulation of nitric oxide mediated signal transduction / cysteine biosynthetic process / L-cysteine catabolic process / cerebellum morphogenesis /  nitric oxide binding / cysteine biosynthetic process from serine / DNA protection / nitric oxide binding / cysteine biosynthetic process from serine / DNA protection /  transsulfuration / transsulfuration /  endochondral ossification / endochondral ossification /  S-adenosyl-L-methionine binding / response to folic acid / S-adenosyl-L-methionine binding / response to folic acid /  nitrite reductase (NO-forming) activity / superoxide metabolic process / maternal process involved in female pregnancy / blood vessel remodeling / blood vessel diameter maintenance / nitrite reductase (NO-forming) activity / superoxide metabolic process / maternal process involved in female pregnancy / blood vessel remodeling / blood vessel diameter maintenance /  oxygen binding / oxygen binding /  pyridoxal phosphate binding / cellular response to hypoxia / pyridoxal phosphate binding / cellular response to hypoxia /  ubiquitin protein ligase binding / ubiquitin protein ligase binding /  heme binding / negative regulation of apoptotic process / heme binding / negative regulation of apoptotic process /  enzyme binding / protein homodimerization activity / identical protein binding / enzyme binding / protein homodimerization activity / identical protein binding /  metal ion binding / metal ion binding /  細胞核 / 細胞核 /  細胞質基質 / 細胞質基質 /  細胞質 細胞質類似検索 - 分子機能 | |||||||||
| 生物種 |   Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||
| 手法 |  単粒子再構成法 / 単粒子再構成法 /  クライオ電子顕微鏡法 / 解像度: 3.8 Å クライオ電子顕微鏡法 / 解像度: 3.8 Å | |||||||||
 データ登録者 データ登録者 | McCorvie TJ / Yue WW | |||||||||
| 資金援助 |  英国, 1件 英国, 1件
| |||||||||
 引用 引用 |  ジャーナル: Nat Commun / 年: 2024 ジャーナル: Nat Commun / 年: 2024タイトル: Architecture and regulation of filamentous human cystathionine beta-synthase. 著者: Thomas J McCorvie / Douglas Adamoski / Raquel A C Machado / Jiazhi Tang / Henry J Bailey / Douglas S M Ferreira / Claire Strain-Damerell / Arnaud Baslé / Andre L B Ambrosio / Sandra M G Dias / Wyatt W Yue /    要旨: Cystathionine beta-synthase (CBS) is an essential metabolic enzyme across all domains of life for the production of glutathione, cysteine, and hydrogen sulfide. Appended to the conserved catalytic ...Cystathionine beta-synthase (CBS) is an essential metabolic enzyme across all domains of life for the production of glutathione, cysteine, and hydrogen sulfide. Appended to the conserved catalytic domain of human CBS is a regulatory domain that modulates activity by S-adenosyl-L-methionine (SAM) and promotes oligomerisation. Here we show using cryo-electron microscopy that full-length human CBS in the basal and SAM-bound activated states polymerises as filaments mediated by a conserved regulatory domain loop. In the basal state, CBS regulatory domains sterically block the catalytic domain active site, resulting in a low-activity filament with three CBS dimers per turn. This steric block is removed when in the activated state, one SAM molecule binds to the regulatory domain, forming a high-activity filament with two CBS dimers per turn. These large conformational changes result in a central filament of SAM-stabilised regulatory domains at the core, decorated with highly flexible catalytic domains. Polymerisation stabilises CBS and reduces thermal denaturation. In PC-3 cells, we observed nutrient-responsive CBS filamentation that disassembles when methionine is depleted and reversed in the presence of SAM. Together our findings extend our understanding of CBS enzyme regulation, and open new avenues for investigating the pathogenic mechanism and therapeutic opportunities for CBS-associated disorders. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_19738.map.gz emd_19738.map.gz | 450.5 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-19738-v30.xml emd-19738-v30.xml emd-19738.xml emd-19738.xml | 20.5 KB 20.5 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_19738_fsc.xml emd_19738_fsc.xml | 16.7 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_19738.png emd_19738.png | 48.8 KB | ||
| マスクデータ |  emd_19738_msk_1.map emd_19738_msk_1.map | 476.8 MB |  マスクマップ マスクマップ | |
| Filedesc metadata |  emd-19738.cif.gz emd-19738.cif.gz | 6.5 KB | ||
| その他 |  emd_19738_additional_1.map.gz emd_19738_additional_1.map.gz emd_19738_half_map_1.map.gz emd_19738_half_map_1.map.gz emd_19738_half_map_2.map.gz emd_19738_half_map_2.map.gz | 237.9 MB 442.8 MB 442.8 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-19738 http://ftp.pdbj.org/pub/emdb/structures/EMD-19738 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-19738 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-19738 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_19738.map.gz / 形式: CCP4 / 大きさ: 476.8 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_19738.map.gz / 形式: CCP4 / 大きさ: 476.8 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ボクセルのサイズ | X=Y=Z: 0.934 Å | ||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-マスク #1
| ファイル |  emd_19738_msk_1.map emd_19738_msk_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
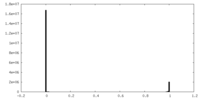
| 密度ヒストグラム |
-追加マップ: Non-sharpened map
| ファイル | emd_19738_additional_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Non-sharpened map | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
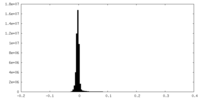
| 密度ヒストグラム |
-ハーフマップ: #2
| ファイル | emd_19738_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: #1
| ファイル | emd_19738_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : Helical assembly of full-length human cystathionine beta-synthase...
| 全体 | 名称: Helical assembly of full-length human cystathionine beta-synthase in the basal state |
|---|---|
| 要素 |
|
-超分子 #1: Helical assembly of full-length human cystathionine beta-synthase...
| 超分子 | 名称: Helical assembly of full-length human cystathionine beta-synthase in the basal state タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: #1 |
|---|---|
| 由来(天然) | 生物種:   Homo sapiens (ヒト) Homo sapiens (ヒト) |
-分子 #1: Cystathionine beta-synthase
| 分子 | 名称: Cystathionine beta-synthase / タイプ: protein_or_peptide / ID: 1 / コピー数: 8 / 光学異性体: LEVO / EC番号:  cystathionine beta-synthase cystathionine beta-synthase |
|---|---|
| 由来(天然) | 生物種:   Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 60.980578 KDa |
| 組換発現 | 生物種:   Escherichia coli (大腸菌) Escherichia coli (大腸菌) |
| 配列 | 文字列: SMPSETPQAE VGPTGCPHRS GPHSAKGSLE KGSPEDKEAK EPLWIRPDAP SRCTWQLGRP ASESPHHHTA PAKSPKILPD ILKKIGDTP MVRINKIGKK FGLKCELLAK CEFFNAGGSV (LLP)DRISLRMIE DAERDGTLKP GDTIIEPTSG NTGIGLA LA ...文字列: SMPSETPQAE VGPTGCPHRS GPHSAKGSLE KGSPEDKEAK EPLWIRPDAP SRCTWQLGRP ASESPHHHTA PAKSPKILPD ILKKIGDTP MVRINKIGKK FGLKCELLAK CEFFNAGGSV (LLP)DRISLRMIE DAERDGTLKP GDTIIEPTSG NTGIGLA LA AAVRGYRCII VMPEKMSSEK VDVLRALGAE IVRTPTNARF DSPESHVGVA WRLKNEIPNS HILDQYRNAS NPLAHYDT T ADEILQQCDG KLDMLVASVG TGGTITGIAR KLKEKCPGCR IIGVDPEGSI LAEPEELNQT EQTTYEVEGI GYDFIPTVL DRTVVDKWFK SNDEEAFTFA RMLIAQEGLL CGGSAGSTVA VAVKAAQELQ EGQRCVVILP DSVRNYMTKF LSDRWMLQKG FLKEEDLTE KKPWWWHLRV QELGLSAPLT VLPTITCGHT IEILREKGFD QAPVVDEAGV ILGMVTLGNM LSSLLAGKVQ P SDQVGKVI YKQFKQIRLT DTLGRLSHIL EMDHFALVVH EQIQYHSTGK SSQRQMVFGV VTAIDLLNFV AAQERDQK UniProtKB:  Cystathionine beta-synthase Cystathionine beta-synthase |
-分子 #2: PROTOPORPHYRIN IX CONTAINING FE
| 分子 | 名称: PROTOPORPHYRIN IX CONTAINING FE / タイプ: ligand / ID: 2 / コピー数: 8 / 式: HEM |
|---|---|
| 分子量 | 理論値: 616.487 Da |
| Chemical component information |  ChemComp-HEM: |
-実験情報
-構造解析
| 手法 |  クライオ電子顕微鏡法 クライオ電子顕微鏡法 |
|---|---|
 解析 解析 |  単粒子再構成法 単粒子再構成法 |
| 試料の集合状態 | filament |
- 試料調製
試料調製
| 濃度 | 1.0 mg/mL | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 緩衝液 | pH: 7.5 構成要素:
詳細: filter sterile 25 mM HEPES, pH 7.5, 200 mM NaCl, 2.0 mM TCEP, 0.005% (v/v) tween-20 | |||||||||||||||
| グリッド | モデル: Quantifoil R1.2/1.3 / 材質: GOLD / メッシュ: 300 / 前処理 - タイプ: GLOW DISCHARGE | |||||||||||||||
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 100 % / チャンバー内温度: 277 K / 装置: FEI VITROBOT MARK IV |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | TFS GLACIOS |
|---|---|
| 電子線 | 加速電圧: 200 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD Bright-field microscopy / 最大 デフォーカス(公称値): 2.0 µm Bright-field microscopy / 最大 デフォーカス(公称値): 2.0 µm最小 デフォーカス(公称値): 1.4000000000000001 µm 倍率(公称値): 150000 |
| 試料ステージ | 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER ホルダー冷却材: NITROGEN |
| 撮影 | フィルム・検出器のモデル: FEI FALCON IV (4k x 4k) 検出モード: COUNTING / 撮影したグリッド数: 1 / 実像数: 2628 / 平均露光時間: 5.18 sec. / 平均電子線量: 50.0 e/Å2 |
 ムービー
ムービー コントローラー
コントローラー



















 Z
Z Y
Y X
X