+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-1629 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | 3D EM reconstruction of Hsp104(157-908) ATP gamma S | |||||||||
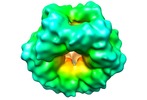
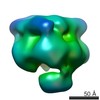
 マップデータ マップデータ | Hsp104(157-908) hexamer with ATP gamma S | |||||||||
 試料 試料 |
| |||||||||
| 生物種 |   Saccharomyces cerevisiae (パン酵母) Saccharomyces cerevisiae (パン酵母) | |||||||||
| 手法 |  単粒子再構成法 / 単粒子再構成法 /  クライオ電子顕微鏡法 / 解像度: 11.1 Å クライオ電子顕微鏡法 / 解像度: 11.1 Å | |||||||||
 データ登録者 データ登録者 | Lee S / Sielaff B / Lee J / Tsai FTF | |||||||||
 引用 引用 |  ジャーナル: Proc Natl Acad Sci U S A / 年: 2010 ジャーナル: Proc Natl Acad Sci U S A / 年: 2010タイトル: CryoEM structure of Hsp104 and its mechanistic implication for protein disaggregation. 著者: Sukyeong Lee / Bernhard Sielaff / Jungsoon Lee / Francis T F Tsai /  要旨: Hsp104 is a ring-forming AAA+ machine that recognizes both aggregated proteins and prion-fibrils as substrates and, together with the Hsp70 system, remodels substrates in an ATP-dependent manner. ...Hsp104 is a ring-forming AAA+ machine that recognizes both aggregated proteins and prion-fibrils as substrates and, together with the Hsp70 system, remodels substrates in an ATP-dependent manner. Whereas the ability to disaggregate proteins is dependent on the Hsp104 M-domain, the location of the M-domain is controversial and its exact function remains unknown. Here we present cryoEM structures of two Hsp104 variants in both crosslinked and noncrosslinked form, in addition to the structure of a functional Hsp104 chimera harboring T4 lysozyme within the M-domain helix L2. Unexpectedly, we found that our Hsp104 chimera has gained function and can solubilize heat-aggregated beta-galactosidase (beta-gal) in the absence of the Hsp70 system. Our fitted structures confirm that the subunit arrangement of Hsp104 is similar to other AAA+ machines, and place the M-domains on the Hsp104 exterior, where they can potentially interact with large, aggregated proteins. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_1629.map.gz emd_1629.map.gz | 7.1 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-1629-v30.xml emd-1629-v30.xml emd-1629.xml emd-1629.xml | 8.7 KB 8.7 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  1629.png 1629.png | 445.1 KB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-1629 http://ftp.pdbj.org/pub/emdb/structures/EMD-1629 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-1629 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-1629 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_1629.map.gz / 形式: CCP4 / 大きさ: 7.8 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_1629.map.gz / 形式: CCP4 / 大きさ: 7.8 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Hsp104(157-908) hexamer with ATP gamma S | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.81 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
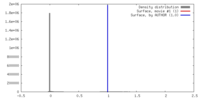
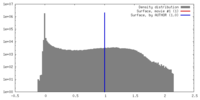
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
- 試料の構成要素
試料の構成要素
-全体 : N-terminal 156 amino acid deleted Hsp104
| 全体 | 名称: N-terminal 156 amino acid deleted Hsp104 |
|---|---|
| 要素 |
|
-超分子 #1000: N-terminal 156 amino acid deleted Hsp104
| 超分子 | 名称: N-terminal 156 amino acid deleted Hsp104 / タイプ: sample / ID: 1000 / 集合状態: Hexamer / Number unique components: 1 |
|---|---|
| 分子量 | 実験値: 500 KDa / 理論値: 500 KDa / 手法: Calculated from amino acid sequences |
-分子 #1: Hsp104
| 分子 | 名称: Hsp104 / タイプ: protein_or_peptide / ID: 1 / Name.synonym: Hsp104 / コピー数: 6 / 集合状態: Hexamer / 組換発現: Yes |
|---|---|
| 由来(天然) | 生物種:   Saccharomyces cerevisiae (パン酵母) / 別称: Yeast / 細胞: Escherichia coli / 細胞中の位置: Cytoplasm Saccharomyces cerevisiae (パン酵母) / 別称: Yeast / 細胞: Escherichia coli / 細胞中の位置: Cytoplasm |
| 組換発現 | 生物種:   Escherichia coli (大腸菌) / 組換プラスミド: pProEX HTb Escherichia coli (大腸菌) / 組換プラスミド: pProEX HTb |
-実験情報
-構造解析
| 手法 |  クライオ電子顕微鏡法 クライオ電子顕微鏡法 |
|---|---|
 解析 解析 |  単粒子再構成法 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 0.3 mg/mL |
|---|---|
| 緩衝液 | pH: 7.5 詳細: 50mM MOPS, pH 7.5, 10 mM MgCl2,2mM DTT, 1.5mM ATP Gamma S |
| グリッド | 詳細: 400 mesh copper grid |
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 100 % / チャンバー内温度: 83 K / 装置: OTHER / 詳細: Vitrification instrument: Vitrobot / 手法: Blot for 5 seconds before plunging |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | JEOL 2010F |
|---|---|
| 電子線 | 加速電圧: 200 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 倍率(補正後): 60000 / 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD Bright-field microscopy / Cs: 2 mm / 最大 デフォーカス(公称値): 4.3 µm / 最小 デフォーカス(公称値): 1.1 µm / 倍率(公称値): 60000 Bright-field microscopy / Cs: 2 mm / 最大 デフォーカス(公称値): 4.3 µm / 最小 デフォーカス(公称値): 1.1 µm / 倍率(公称値): 60000 |
| 試料ステージ | 試料ホルダー: Eucentric / 試料ホルダーモデル: GATAN LIQUID NITROGEN |
| 温度 | 平均: 94 K |
| アライメント法 | Legacy - 非点収差: Objective lens astigmatism was corrected at 400,000 x magnification |
| 日付 | 2008年1月17日 |
| 撮影 | カテゴリ: CCD フィルム・検出器のモデル: GENERIC GATAN (4k x 4k) 平均電子線量: 16 e/Å2 |
- 画像解析
画像解析
| CTF補正 | 詳細: Each CCD image |
|---|---|
| 最終 再構成 | 想定した対称性 - 点群: C6 (6回回転対称 ) / アルゴリズム: OTHER / 解像度のタイプ: BY AUTHOR / 解像度: 11.1 Å / 解像度の算出法: OTHER / ソフトウェア - 名称: EMAN ) / アルゴリズム: OTHER / 解像度のタイプ: BY AUTHOR / 解像度: 11.1 Å / 解像度の算出法: OTHER / ソフトウェア - 名称: EMAN |
 ムービー
ムービー コントローラー
コントローラー










 Z (Sec.)
Z (Sec.) X (Row.)
X (Row.) Y (Col.)
Y (Col.)