+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Lipidic alpha-synuclein fibril - polymorph L1B | |||||||||||||||
 マップデータ マップデータ | Lipidic alpha-synuclein fibril - polymorph L1B | |||||||||||||||
 試料 試料 |
| |||||||||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報negative regulation of mitochondrial electron transport, NADH to ubiquinone / neutral lipid metabolic process /  regulation of phospholipase activity / negative regulation of monooxygenase activity / regulation of acyl-CoA biosynthetic process / negative regulation of dopamine uptake involved in synaptic transmission / negative regulation of norepinephrine uptake / positive regulation of glutathione peroxidase activity / positive regulation of SNARE complex assembly / positive regulation of hydrogen peroxide catabolic process ...negative regulation of mitochondrial electron transport, NADH to ubiquinone / neutral lipid metabolic process / regulation of phospholipase activity / negative regulation of monooxygenase activity / regulation of acyl-CoA biosynthetic process / negative regulation of dopamine uptake involved in synaptic transmission / negative regulation of norepinephrine uptake / positive regulation of glutathione peroxidase activity / positive regulation of SNARE complex assembly / positive regulation of hydrogen peroxide catabolic process ...negative regulation of mitochondrial electron transport, NADH to ubiquinone / neutral lipid metabolic process /  regulation of phospholipase activity / negative regulation of monooxygenase activity / regulation of acyl-CoA biosynthetic process / negative regulation of dopamine uptake involved in synaptic transmission / negative regulation of norepinephrine uptake / positive regulation of glutathione peroxidase activity / positive regulation of SNARE complex assembly / positive regulation of hydrogen peroxide catabolic process / supramolecular fiber / negative regulation of transporter activity / negative regulation of chaperone-mediated autophagy / mitochondrial membrane organization / regulation of reactive oxygen species biosynthetic process / positive regulation of protein localization to cell periphery / regulation of phospholipase activity / negative regulation of monooxygenase activity / regulation of acyl-CoA biosynthetic process / negative regulation of dopamine uptake involved in synaptic transmission / negative regulation of norepinephrine uptake / positive regulation of glutathione peroxidase activity / positive regulation of SNARE complex assembly / positive regulation of hydrogen peroxide catabolic process / supramolecular fiber / negative regulation of transporter activity / negative regulation of chaperone-mediated autophagy / mitochondrial membrane organization / regulation of reactive oxygen species biosynthetic process / positive regulation of protein localization to cell periphery /  regulation of synaptic vesicle recycling / negative regulation of platelet-derived growth factor receptor signaling pathway / negative regulation of exocytosis / regulation of glutamate secretion / response to iron(II) ion / regulation of norepinephrine uptake / dopamine biosynthetic process / regulation of synaptic vesicle recycling / negative regulation of platelet-derived growth factor receptor signaling pathway / negative regulation of exocytosis / regulation of glutamate secretion / response to iron(II) ion / regulation of norepinephrine uptake / dopamine biosynthetic process /  SNARE complex assembly / positive regulation of neurotransmitter secretion / synaptic vesicle priming / dopamine uptake involved in synaptic transmission / regulation of locomotion / positive regulation of inositol phosphate biosynthetic process / SNARE complex assembly / positive regulation of neurotransmitter secretion / synaptic vesicle priming / dopamine uptake involved in synaptic transmission / regulation of locomotion / positive regulation of inositol phosphate biosynthetic process /  regulation of macrophage activation / mitochondrial ATP synthesis coupled electron transport / negative regulation of microtubule polymerization / synaptic vesicle transport / dynein complex binding / positive regulation of receptor recycling / regulation of dopamine secretion / regulation of macrophage activation / mitochondrial ATP synthesis coupled electron transport / negative regulation of microtubule polymerization / synaptic vesicle transport / dynein complex binding / positive regulation of receptor recycling / regulation of dopamine secretion /  protein kinase inhibitor activity / negative regulation of thrombin-activated receptor signaling pathway / response to type II interferon / cuprous ion binding / positive regulation of exocytosis / synaptic vesicle exocytosis / positive regulation of endocytosis / cysteine-type endopeptidase inhibitor activity involved in apoptotic process / response to magnesium ion / protein kinase inhibitor activity / negative regulation of thrombin-activated receptor signaling pathway / response to type II interferon / cuprous ion binding / positive regulation of exocytosis / synaptic vesicle exocytosis / positive regulation of endocytosis / cysteine-type endopeptidase inhibitor activity involved in apoptotic process / response to magnesium ion /  kinesin binding / regulation of presynapse assembly / alpha-tubulin binding / synaptic vesicle endocytosis / negative regulation of serotonin uptake / localization / phospholipid metabolic process / supramolecular fiber organization / axon terminus / kinesin binding / regulation of presynapse assembly / alpha-tubulin binding / synaptic vesicle endocytosis / negative regulation of serotonin uptake / localization / phospholipid metabolic process / supramolecular fiber organization / axon terminus /  封入体 / cellular response to copper ion / 封入体 / cellular response to copper ion /  Hsp70 protein binding / cellular response to epinephrine stimulus / Hsp70 protein binding / cellular response to epinephrine stimulus /  excitatory postsynaptic potential / response to interleukin-1 / adult locomotory behavior / excitatory postsynaptic potential / response to interleukin-1 / adult locomotory behavior /  SNARE binding / positive regulation of release of sequestered calcium ion into cytosol / fatty acid metabolic process / long-term synaptic potentiation / regulation of transmembrane transporter activity / SNARE binding / positive regulation of release of sequestered calcium ion into cytosol / fatty acid metabolic process / long-term synaptic potentiation / regulation of transmembrane transporter activity /  ferrous iron binding / protein tetramerization / synapse organization / ferrous iron binding / protein tetramerization / synapse organization /  phosphoprotein binding / regulation of long-term neuronal synaptic plasticity / microglial cell activation / negative regulation of protein kinase activity / phosphoprotein binding / regulation of long-term neuronal synaptic plasticity / microglial cell activation / negative regulation of protein kinase activity /  phospholipid binding / protein destabilization / PKR-mediated signaling / negative regulation of cysteine-type endopeptidase activity involved in apoptotic process / tau protein binding / positive regulation of protein serine/threonine kinase activity / phospholipid binding / protein destabilization / PKR-mediated signaling / negative regulation of cysteine-type endopeptidase activity involved in apoptotic process / tau protein binding / positive regulation of protein serine/threonine kinase activity /  receptor internalization / synaptic vesicle membrane / positive regulation of inflammatory response / activation of cysteine-type endopeptidase activity involved in apoptotic process / receptor internalization / synaptic vesicle membrane / positive regulation of inflammatory response / activation of cysteine-type endopeptidase activity involved in apoptotic process /  マイクロフィラメント / positive regulation of peptidyl-serine phosphorylation / cellular response to oxidative stress / マイクロフィラメント / positive regulation of peptidyl-serine phosphorylation / cellular response to oxidative stress /  actin binding / actin binding /  細胞皮質 / 細胞皮質 /  成長円錐 / 成長円錐 /  histone binding / chemical synaptic transmission / postsynapse / neuron apoptotic process / negative regulation of neuron apoptotic process / amyloid fibril formation / response to lipopolysaccharide / histone binding / chemical synaptic transmission / postsynapse / neuron apoptotic process / negative regulation of neuron apoptotic process / amyloid fibril formation / response to lipopolysaccharide /  リソソーム / リソソーム /  oxidoreductase activity / molecular adaptor activity / transcription cis-regulatory region binding oxidoreductase activity / molecular adaptor activity / transcription cis-regulatory region binding類似検索 - 分子機能 | |||||||||||||||
| 生物種 |   Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||||||||
| 手法 | らせん対称体再構成法 /  クライオ電子顕微鏡法 / 解像度: 2.98 Å クライオ電子顕微鏡法 / 解像度: 2.98 Å | |||||||||||||||
 データ登録者 データ登録者 | Frieg B / Antonschmidt L / Dienemann C / Geraets JA / Najbauer EE / Matthes D / de Groot BL / Andreas LB / Becker S / Griesinger C / Schroeder GF | |||||||||||||||
| 資金援助 |  ドイツ, 4件 ドイツ, 4件
| |||||||||||||||
 引用 引用 |  ジャーナル: Nat Commun / 年: 2022 ジャーナル: Nat Commun / 年: 2022タイトル: The 3D structure of lipidic fibrils of α-synuclein. 著者: Benedikt Frieg / Leif Antonschmidt / Christian Dienemann / James A Geraets / Eszter E Najbauer / Dirk Matthes / Bert L de Groot / Loren B Andreas / Stefan Becker / Christian Griesinger / Gunnar F Schröder /  要旨: α-synuclein misfolding and aggregation into fibrils is a common feature of α-synucleinopathies, such as Parkinson's disease, in which α-synuclein fibrils are a characteristic hallmark of neuronal ...α-synuclein misfolding and aggregation into fibrils is a common feature of α-synucleinopathies, such as Parkinson's disease, in which α-synuclein fibrils are a characteristic hallmark of neuronal inclusions called Lewy bodies. Studies on the composition of Lewy bodies extracted postmortem from brain tissue of Parkinson's patients revealed that lipids and membranous organelles are also a significant component. Interactions between α-synuclein and lipids have been previously identified as relevant for Parkinson's disease pathology, however molecular insights into their interactions have remained elusive. Here we present cryo-electron microscopy structures of six α-synuclein fibrils in complex with lipids, revealing specific lipid-fibril interactions. We observe that phospholipids promote an alternative protofilament fold, mediate an unusual arrangement of protofilaments, and fill the central cavities of the fibrils. Together with our previous studies, these structures also indicate a mechanism for fibril-induced lipid extraction, which is likely to be involved in the development of α-synucleinopathies. Specifically, one potential mechanism for the cellular toxicity is the disruption of intracellular vesicles mediated by fibrils and oligomers, and therefore the modulation of these interactions may provide a promising strategy for future therapeutic interventions. | |||||||||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_15371.map.gz emd_15371.map.gz | 11.4 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-15371-v30.xml emd-15371-v30.xml emd-15371.xml emd-15371.xml | 14.9 KB 14.9 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
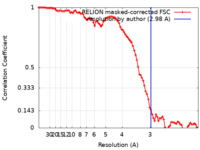
| FSC (解像度算出) |  emd_15371_fsc.xml emd_15371_fsc.xml | 8.9 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_15371.png emd_15371.png | 77.7 KB | ||
| その他 |  emd_15371_half_map_1.map.gz emd_15371_half_map_1.map.gz emd_15371_half_map_2.map.gz emd_15371_half_map_2.map.gz | 46 MB 46 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-15371 http://ftp.pdbj.org/pub/emdb/structures/EMD-15371 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-15371 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-15371 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_15371.map.gz / 形式: CCP4 / 大きさ: 59.6 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_15371.map.gz / 形式: CCP4 / 大きさ: 59.6 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Lipidic alpha-synuclein fibril - polymorph L1B | ||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.05 Å | ||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-ハーフマップ: Lipidic alpha-synuclein fibril - polymorph L1B (half map 1)
| ファイル | emd_15371_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Lipidic alpha-synuclein fibril - polymorph L1B (half map 1) | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: Lipidic alpha-synuclein fibril - polymorph L1B (half map 2)
| ファイル | emd_15371_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Lipidic alpha-synuclein fibril - polymorph L1B (half map 2) | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : Lipidic alpha-synuclein fibril - polymorph L1B
| 全体 | 名称: Lipidic alpha-synuclein fibril - polymorph L1B |
|---|---|
| 要素 |
|
-超分子 #1: Lipidic alpha-synuclein fibril - polymorph L1B
| 超分子 | 名称: Lipidic alpha-synuclein fibril - polymorph L1B / タイプ: complex / キメラ: Yes / ID: 1 / 親要素: 0 / 含まれる分子: all |
|---|---|
| 由来(天然) | 生物種:   Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 組換発現 | 生物種:   Escherichia coli BL21(DE3) (大腸菌) Escherichia coli BL21(DE3) (大腸菌) |
-分子 #1: Alpha-synuclein
| 分子 | 名称: Alpha-synuclein / タイプ: protein_or_peptide / ID: 1 / コピー数: 10 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:   Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 14.476108 KDa |
| 組換発現 | 生物種:   Escherichia coli BL21(DE3) (大腸菌) Escherichia coli BL21(DE3) (大腸菌) |
| 配列 | 文字列: MDVFMKGLSK AKEGVVAAAE KTKQGVAEAA GKTKEGVLYV GSKTKEGVVH GVATVAEKTK EQVTNVGGAV VTGVTAVAQK TVEGAGSIA AATGFVKKDQ LGKNEEGAPQ EGILEDMPVD PDNEAYEMPS EEGYQDYEPE A |
-実験情報
-構造解析
| 手法 |  クライオ電子顕微鏡法 クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | らせん対称体再構成法 |
| 試料の集合状態 | filament |
- 試料調製
試料調製
| 緩衝液 | pH: 7.4 |
|---|---|
| 凍結 | 凍結剤: ETHANE |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD Bright-field microscopy / 最大 デフォーカス(公称値): 2.0 µm / 最小 デフォーカス(公称値): 0.5 µm Bright-field microscopy / 最大 デフォーカス(公称値): 2.0 µm / 最小 デフォーカス(公称値): 0.5 µm |
| 撮影 | フィルム・検出器のモデル: GATAN K3 BIOQUANTUM (6k x 4k) 平均電子線量: 50.83 e/Å2 |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
 ムービー
ムービー コントローラー
コントローラー














 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)