+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Structure of the V2 receptor Cter-arrestin2-ScFv30 complex | |||||||||
 マップデータ マップデータ | ||||||||||
 試料 試料 |
| |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報 angiotensin receptor binding / Activation of SMO / negative regulation of interleukin-8 production / arrestin family protein binding / G protein-coupled receptor internalization / angiotensin receptor binding / Activation of SMO / negative regulation of interleukin-8 production / arrestin family protein binding / G protein-coupled receptor internalization /  enzyme inhibitor activity / Lysosome Vesicle Biogenesis / positive regulation of Rho protein signal transduction / Golgi Associated Vesicle Biogenesis / negative regulation of NF-kappaB transcription factor activity ... enzyme inhibitor activity / Lysosome Vesicle Biogenesis / positive regulation of Rho protein signal transduction / Golgi Associated Vesicle Biogenesis / negative regulation of NF-kappaB transcription factor activity ... angiotensin receptor binding / Activation of SMO / negative regulation of interleukin-8 production / arrestin family protein binding / G protein-coupled receptor internalization / angiotensin receptor binding / Activation of SMO / negative regulation of interleukin-8 production / arrestin family protein binding / G protein-coupled receptor internalization /  enzyme inhibitor activity / Lysosome Vesicle Biogenesis / positive regulation of Rho protein signal transduction / Golgi Associated Vesicle Biogenesis / negative regulation of NF-kappaB transcription factor activity / enzyme inhibitor activity / Lysosome Vesicle Biogenesis / positive regulation of Rho protein signal transduction / Golgi Associated Vesicle Biogenesis / negative regulation of NF-kappaB transcription factor activity /  stress fiber assembly / negative regulation of Notch signaling pathway / stress fiber assembly / negative regulation of Notch signaling pathway /  仮足 / negative regulation of interleukin-6 production / positive regulation of receptor internalization / 仮足 / negative regulation of interleukin-6 production / positive regulation of receptor internalization /  クラスリン / negative regulation of protein ubiquitination / クラスリン / negative regulation of protein ubiquitination /  insulin-like growth factor receptor binding / insulin-like growth factor receptor binding /  視覚 / Activated NOTCH1 Transmits Signal to the Nucleus / 視覚 / Activated NOTCH1 Transmits Signal to the Nucleus /  GTPase activator activity / G protein-coupled receptor binding / Signaling by high-kinase activity BRAF mutants / MAP2K and MAPK activation / cytoplasmic vesicle membrane / Signaling by RAF1 mutants / Signaling by moderate kinase activity BRAF mutants / Paradoxical activation of RAF signaling by kinase inactive BRAF / Signaling downstream of RAS mutants / Signaling by BRAF and RAF1 fusions / Thrombin signalling through proteinase activated receptors (PARs) / GTPase activator activity / G protein-coupled receptor binding / Signaling by high-kinase activity BRAF mutants / MAP2K and MAPK activation / cytoplasmic vesicle membrane / Signaling by RAF1 mutants / Signaling by moderate kinase activity BRAF mutants / Paradoxical activation of RAF signaling by kinase inactive BRAF / Signaling downstream of RAS mutants / Signaling by BRAF and RAF1 fusions / Thrombin signalling through proteinase activated receptors (PARs) /  protein transport / Cargo recognition for clathrin-mediated endocytosis / protein transport / Cargo recognition for clathrin-mediated endocytosis /  Clathrin-mediated endocytosis / ubiquitin-dependent protein catabolic process / G alpha (s) signalling events / cytoplasmic vesicle / proteasome-mediated ubiquitin-dependent protein catabolic process / Clathrin-mediated endocytosis / ubiquitin-dependent protein catabolic process / G alpha (s) signalling events / cytoplasmic vesicle / proteasome-mediated ubiquitin-dependent protein catabolic process /  transcription coactivator activity / positive regulation of ERK1 and ERK2 cascade / protein ubiquitination / transcription coactivator activity / positive regulation of ERK1 and ERK2 cascade / protein ubiquitination /  nuclear body / Ub-specific processing proteases / positive regulation of protein phosphorylation / lysosomal membrane / nuclear body / Ub-specific processing proteases / positive regulation of protein phosphorylation / lysosomal membrane /  ゴルジ体 / ゴルジ体 /  ubiquitin protein ligase binding / ubiquitin protein ligase binding /  クロマチン / regulation of transcription by RNA polymerase II / クロマチン / regulation of transcription by RNA polymerase II /  シグナル伝達 / positive regulation of transcription by RNA polymerase II / シグナル伝達 / positive regulation of transcription by RNA polymerase II /  核質 / 核質 /  細胞核 / 細胞核 /  細胞膜 / 細胞膜 /  細胞質基質 / 細胞質基質 /  細胞質 細胞質類似検索 - 分子機能 | |||||||||
| 生物種 |   Homo sapiens (ヒト) / synthetic construct (人工物) Homo sapiens (ヒト) / synthetic construct (人工物) | |||||||||
| 手法 |  単粒子再構成法 / 単粒子再構成法 /  クライオ電子顕微鏡法 / 解像度: 4.23 Å クライオ電子顕微鏡法 / 解像度: 4.23 Å | |||||||||
 データ登録者 データ登録者 | Bous J / Fouillen A / Trapani S / Granier S / Mouillac B / Bron P | |||||||||
| 資金援助 |  フランス, 2件 フランス, 2件
| |||||||||
 引用 引用 |  ジャーナル: Sci Adv / 年: 2022 ジャーナル: Sci Adv / 年: 2022タイトル: Structure of the vasopressin hormone-V2 receptor-β-arrestin1 ternary complex. 著者: Julien Bous / Aurélien Fouillen / Hélène Orcel / Stefano Trapani / Xiaojing Cong / Simon Fontanel / Julie Saint-Paul / Joséphine Lai-Kee-Him / Serge Urbach / Nathalie Sibille / Rémy ...著者: Julien Bous / Aurélien Fouillen / Hélène Orcel / Stefano Trapani / Xiaojing Cong / Simon Fontanel / Julie Saint-Paul / Joséphine Lai-Kee-Him / Serge Urbach / Nathalie Sibille / Rémy Sounier / Sébastien Granier / Bernard Mouillac / Patrick Bron /  要旨: Arrestins interact with G protein-coupled receptors (GPCRs) to stop G protein activation and to initiate key signaling pathways. Recent structural studies shed light on the molecular mechanisms ...Arrestins interact with G protein-coupled receptors (GPCRs) to stop G protein activation and to initiate key signaling pathways. Recent structural studies shed light on the molecular mechanisms involved in GPCR-arrestin coupling, but whether this process is conserved among GPCRs is poorly understood. Here, we report the cryo-electron microscopy active structure of the wild-type arginine-vasopressin V2 receptor (V2R) in complex with β-arrestin1. It reveals an atypical position of β-arrestin1 compared to previously described GPCR-arrestin assemblies, associated with an original V2R/β-arrestin1 interface involving all receptor intracellular loops. Phosphorylated sites of the V2R carboxyl terminus are clearly identified and interact extensively with the β-arrestin1 N-lobe, in agreement with structural data obtained with chimeric or synthetic systems. Overall, these findings highlight a notable structural variability among GPCR-arrestin signaling complexes. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
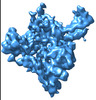
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_14223.map.gz emd_14223.map.gz | 9.8 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-14223-v30.xml emd-14223-v30.xml emd-14223.xml emd-14223.xml | 21.1 KB 21.1 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_14223_fsc.xml emd_14223_fsc.xml | 4.6 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_14223.png emd_14223.png | 89.2 KB | ||
| マスクデータ |  emd_14223_msk_1.map emd_14223_msk_1.map | 10.5 MB |  マスクマップ マスクマップ | |
| その他 |  emd_14223_additional_1.map.gz emd_14223_additional_1.map.gz emd_14223_half_map_1.map.gz emd_14223_half_map_1.map.gz emd_14223_half_map_2.map.gz emd_14223_half_map_2.map.gz | 5 MB 9.7 MB 9.7 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-14223 http://ftp.pdbj.org/pub/emdb/structures/EMD-14223 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-14223 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-14223 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  7r0jMC  7r0cC C: 同じ文献を引用 ( M: このマップから作成された原子モデル |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_14223.map.gz / 形式: CCP4 / 大きさ: 10.5 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_14223.map.gz / 形式: CCP4 / 大きさ: 10.5 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.28 Å | ||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-マスク #1
| ファイル |  emd_14223_msk_1.map emd_14223_msk_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-追加マップ: #1
| ファイル | emd_14223_additional_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: #2
| ファイル | emd_14223_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: #1
| ファイル | emd_14223_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : Ternary complex of the Cterminal portion of the V2 receptor with ...
| 全体 | 名称: Ternary complex of the Cterminal portion of the V2 receptor with arrestin2 and ScfV30 |
|---|---|
| 要素 |
|
-超分子 #1: Ternary complex of the Cterminal portion of the V2 receptor with ...
| 超分子 | 名称: Ternary complex of the Cterminal portion of the V2 receptor with arrestin2 and ScfV30 タイプ: complex / キメラ: Yes / ID: 1 / 親要素: 0 / 含まれる分子: all |
|---|---|
| 由来(天然) | 生物種:   Homo sapiens (ヒト) Homo sapiens (ヒト) |
-分子 #1: V2R Cter
| 分子 | 名称: V2R Cter / タイプ: protein_or_peptide / ID: 1 / コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:   Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 1.780248 KDa |
| 組換発現 | 生物種: Insect expression vector pBlueBacmsGCA1 (その他) |
| 配列 | 文字列: E(SEP)C(TPO)(TPO)A(SEP)(SEP)(SEP)L AKD |
-分子 #2: Arrestin2
| 分子 | 名称: Arrestin2 / タイプ: protein_or_peptide / ID: 2 / コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:   Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 47.164609 KDa |
| 組換発現 | 生物種:   Escherichia coli (大腸菌) Escherichia coli (大腸菌) |
| 配列 | 文字列: MGASWSHPQF EKGGGSGGGS GGSSAWSHPQ FEKLEVLFQG PASGDKGTRV FKKASPNGKL TVYLGKRDFV DHIDLVDPVD GVVLVDPEY LKERRVYVTL TCAFRYGRED LDVLGLTFRK DLFVANVQSF PPAPEDKKPL TRLQERLIKK LGEHAYPFTF E IPPNLPCS ...文字列: MGASWSHPQF EKGGGSGGGS GGSSAWSHPQ FEKLEVLFQG PASGDKGTRV FKKASPNGKL TVYLGKRDFV DHIDLVDPVD GVVLVDPEY LKERRVYVTL TCAFRYGRED LDVLGLTFRK DLFVANVQSF PPAPEDKKPL TRLQERLIKK LGEHAYPFTF E IPPNLPCS VTLQPGPEDT GKACGVDYEV KAFCAENLEE KIHKRNSVRL VIRKVQYAPE RPGPQPTAET TRQFLMSDKP LH LEASLDK EIYYHGEPIS VNVHVTNNTN KTVKKIKISV RQYADICLFN TAQYKCPVAM EEADDTVAPS STFCKVYTLT PFL ANNREK RGLALDGKLK HEDTNLASST LLREGANREI LGIIVSYKVK VKLVVSRGGL LGDLASSDVA VELPFTLMHP KPKE EPPHR EVPENETPVD TNLIELDTN |
-分子 #3: ScFv30
| 分子 | 名称: ScFv30 / タイプ: protein_or_peptide / ID: 3 / コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種: synthetic construct (人工物) |
| 分子量 | 理論値: 30.070027 KDa |
| 組換発現 | 生物種: Insect expression vector pBlueBacmsGCA1 (その他) |
| 配列 | 文字列: AMGDIQMTQS PSSLSASVGD RVTITCRASQ SVSSAVAWYQ QKPGKAPKLL IYSASSLYSG VPSRFSGSRS GTDFTLTISS LQPEDFATY YCQQYKYVPV TFGCGTKVEI KGTTAASGSS GGSSSGAEVQ LVESGGGLVQ PGGSLRLSCA ASGFNVYSSS I HWVRQAPG ...文字列: AMGDIQMTQS PSSLSASVGD RVTITCRASQ SVSSAVAWYQ QKPGKAPKLL IYSASSLYSG VPSRFSGSRS GTDFTLTISS LQPEDFATY YCQQYKYVPV TFGCGTKVEI KGTTAASGSS GGSSSGAEVQ LVESGGGLVQ PGGSLRLSCA ASGFNVYSSS I HWVRQAPG KCLEWVASIS SYYGYTYYAD SVKGRFTISA DTSKNTAYLQ MNSLRAEDTA VYYCARSRQF WYSGLDYWGQ GT LVTVSSA AADDDDKAGW SHPQFEKGGG SGGGSGGGSW SHPQFEK |
-実験情報
-構造解析
| 手法 |  クライオ電子顕微鏡法 クライオ電子顕微鏡法 |
|---|---|
 解析 解析 |  単粒子再構成法 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 3 mg/mL |
|---|---|
| 緩衝液 | pH: 7.5 |
| グリッド | モデル: UltrAuFoil R1.2/1.3 / 材質: GOLD / メッシュ: 300 / 支持フィルム - 材質: GOLD / 支持フィルム - トポロジー: CONTINUOUS / 前処理 - タイプ: GLOW DISCHARGE |
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 100 % / チャンバー内温度: 277 K / 装置: LEICA EM GP |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | C2レンズ絞り径: 50.0 µm / 倍率(補正後): 130000 / 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD Bright-field microscopy / Cs: 2.7 mm / 最大 デフォーカス(公称値): 2.0 µm / 最小 デフォーカス(公称値): 1.0 µm Bright-field microscopy / Cs: 2.7 mm / 最大 デフォーカス(公称値): 2.0 µm / 最小 デフォーカス(公称値): 1.0 µm |
| 試料ステージ | ホルダー冷却材: NITROGEN |
| 撮影 | フィルム・検出器のモデル: GATAN K3 BIOQUANTUM (6k x 4k) 実像数: 14080 / 平均露光時間: 1.0 sec. / 平均電子線量: 52.0 e/Å2 |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
 ムービー
ムービー コントローラー
コントローラー









 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)