+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-2934 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | 3D Reconstruction of Membrane Protein Complex ExbB4-ExbD1-TonB1 | |||||||||
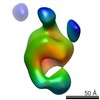
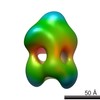
 マップデータ マップデータ | ExbB4-ExbD1-TonB1 showing periplasmic distal heterodimerization and cytoplasmic tetrameric arrangement | |||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード |  Membrane protein complex (生体膜) / Membrane protein complex (生体膜) /  heterodimerization / coordinated rearrangement / iron import heterodimerization / coordinated rearrangement / iron import | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報receptor-mediated bacteriophage irreversible attachment to host cell / colicin transport / energy transducer activity /  cell envelope / bacteriocin transport / cobalamin transport / siderophore transport / intracellular monoatomic cation homeostasis / protein import / cell envelope / bacteriocin transport / cobalamin transport / siderophore transport / intracellular monoatomic cation homeostasis / protein import /  plasma membrane protein complex ...receptor-mediated bacteriophage irreversible attachment to host cell / colicin transport / energy transducer activity / plasma membrane protein complex ...receptor-mediated bacteriophage irreversible attachment to host cell / colicin transport / energy transducer activity /  cell envelope / bacteriocin transport / cobalamin transport / siderophore transport / intracellular monoatomic cation homeostasis / protein import / cell envelope / bacteriocin transport / cobalamin transport / siderophore transport / intracellular monoatomic cation homeostasis / protein import /  plasma membrane protein complex / transmembrane transporter complex / transmembrane transporter activity / cell outer membrane / transmembrane transport / plasma membrane protein complex / transmembrane transporter complex / transmembrane transporter activity / cell outer membrane / transmembrane transport /  protein transport / outer membrane-bounded periplasmic space / intracellular iron ion homeostasis / membrane => GO:0016020 / protein stabilization / protein domain specific binding / protein homodimerization activity / protein transport / outer membrane-bounded periplasmic space / intracellular iron ion homeostasis / membrane => GO:0016020 / protein stabilization / protein domain specific binding / protein homodimerization activity /  生体膜 / identical protein binding / 生体膜 / identical protein binding /  細胞膜 細胞膜類似検索 - 分子機能 | |||||||||
| 生物種 |   Escherichia coli K-12 (大腸菌) Escherichia coli K-12 (大腸菌) | |||||||||
| 手法 |  単粒子再構成法 / 単粒子再構成法 /  ネガティブ染色法 / 解像度: 23.0 Å ネガティブ染色法 / 解像度: 23.0 Å | |||||||||
 データ登録者 データ登録者 | Sverzhinsky A / Chung JWC / Deme JC / Fabre L / Levey KT / Plesa M / Carter DM / Lypaczewski P / Coulton JW | |||||||||
 引用 引用 |  ジャーナル: J Bacteriol / 年: 2015 ジャーナル: J Bacteriol / 年: 2015タイトル: Membrane Protein Complex ExbB4-ExbD1-TonB1 from Escherichia coli Demonstrates Conformational Plasticity. 著者: Aleksandr Sverzhinsky / Jacqueline W Chung / Justin C Deme / Lucien Fabre / Kristian T Levey / Maria Plesa / David M Carter / Patrick Lypaczewski / James W Coulton /  要旨: Iron acquisition at the outer membrane (OM) of Gram-negative bacteria is powered by the proton motive force (PMF) of the cytoplasmic membrane (CM), harnessed by the CM-embedded complex of ExbB, ExbD, ...Iron acquisition at the outer membrane (OM) of Gram-negative bacteria is powered by the proton motive force (PMF) of the cytoplasmic membrane (CM), harnessed by the CM-embedded complex of ExbB, ExbD, and TonB. Its stoichiometry, ensemble structural features, and mechanism of action are unknown. By panning combinatorial phage libraries, periplasmic regions of dimerization between ExbD and TonB were predicted. Using overexpression of full-length His6-tagged exbB-exbD and S-tagged tonB, we purified detergent-solubilized complexes of ExbB-ExbD-TonB from Escherichia coli. Protein-detergent complexes of ∼230 kDa with a hydrodynamic radius of ∼6.0 nm were similar to previously purified ExbB₄-ExbD₂ complexes. Significantly, they differed in electronegativity by native agarose gel electrophoresis. The stoichiometry was determined to be ExbB₄-ExbD₁-TonB₁. Single-particle electron microscopy agrees with this stoichiometry. Two-dimensional averaging supported the phage display predictions, showing two forms of ExbD-TonB periplasmic heterodimerization: extensive and distal. Three-dimensional (3D) particle classification showed three representative conformations of ExbB₄-ExbD₁-TonB₁. Based on our structural data, we propose a model in which ExbD shuttles a proton across the CM via an ExbB interprotein rearrangement. Proton translocation would be coupled to ExbD-mediated collapse of extended TonB in complex with ligand-loaded receptors in the OM, followed by repositioning of TonB through extensive dimerization with ExbD. Here we present the first report for purification of the ExbB-ExbD-TonB complex, molar ratios within the complex (4:1:1), and structural biology that provides insights into 3D organization. IMPORTANCE: Receptors in the OM of Gram-negative bacteria allow entry of iron-bound siderophores that are necessary for pathogenicity. Numerous iron-acquisition strategies rely upon a ubiquitous and ...IMPORTANCE: Receptors in the OM of Gram-negative bacteria allow entry of iron-bound siderophores that are necessary for pathogenicity. Numerous iron-acquisition strategies rely upon a ubiquitous and unique protein for energization: TonB. Complexed with ExbB and ExbD, the Ton system links the PMF to OM transport. Blocking iron uptake by targeting a vital nanomachine holds promise in therapeutics. Despite much research, the stoichiometry, structural arrangement, and molecular mechanism of the CM-embedded ExbB-ExbD-TonB complex remain unreported. Here we demonstrate in vitro evidence of ExbB₄-ExbD₁-TonB₁ complexes. Using 3D EM, we reconstructed the complex in three conformational states that show variable ExbD-TonB heterodimerization. Our structural observations form the basis of a model for TonB-mediated iron acquisition. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_2934.map.gz emd_2934.map.gz | 6.2 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-2934-v30.xml emd-2934-v30.xml emd-2934.xml emd-2934.xml | 12.2 KB 12.2 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  emd_2934.tif emd_2934.tif | 85.3 KB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-2934 http://ftp.pdbj.org/pub/emdb/structures/EMD-2934 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-2934 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-2934 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_2934.map.gz / 形式: CCP4 / 大きさ: 7.8 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_2934.map.gz / 形式: CCP4 / 大きさ: 7.8 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | ExbB4-ExbD1-TonB1 showing periplasmic distal heterodimerization and cytoplasmic tetrameric arrangement | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 2.2 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
- 試料の構成要素
試料の構成要素
-全体 : Membrane protein complex ExbB4-ExbD1-TonB1 from Escherichia coli
| 全体 | 名称: Membrane protein complex ExbB4-ExbD1-TonB1 from Escherichia coli 生体膜 生体膜 |
|---|---|
| 要素 |
|
-超分子 #1000: Membrane protein complex ExbB4-ExbD1-TonB1 from Escherichia coli
| 超分子 | 名称: Membrane protein complex ExbB4-ExbD1-TonB1 from Escherichia coli タイプ: sample / ID: 1000 集合状態: Four ExbB in complex with one ExbD and one TonB Number unique components: 3 |
|---|---|
| 分子量 | 理論値: 150 KDa |
-分子 #1: Biopolymer Transport Protein ExbB
| 分子 | 名称: Biopolymer Transport Protein ExbB / タイプ: protein_or_peptide / ID: 1 / Name.synonym: ExbB / コピー数: 4 / 集合状態: Tetramer / 組換発現: Yes |
|---|---|
| 由来(天然) | 生物種:   Escherichia coli K-12 (大腸菌) / 細胞中の位置: Cytoplasmic Membrane Escherichia coli K-12 (大腸菌) / 細胞中の位置: Cytoplasmic Membrane |
| 分子量 | 理論値: 26 KDa |
| 組換発現 | 生物種:   Escherichia coli BL21(DE3) (大腸菌) / 組換株: pLysS / 組換プラスミド: pETDuet-1 Escherichia coli BL21(DE3) (大腸菌) / 組換株: pLysS / 組換プラスミド: pETDuet-1 |
| 配列 | UniProtKB: Biopolymer transport protein ExbB / GO: membrane => GO:0016020 / InterPro: TonB-system energizer ExbB type-1 |
-分子 #2: Biopolymer Transport Protein ExbD
| 分子 | 名称: Biopolymer Transport Protein ExbD / タイプ: protein_or_peptide / ID: 2 / Name.synonym: ExbD / コピー数: 1 / 集合状態: Monomer / 組換発現: Yes |
|---|---|
| 由来(天然) | 生物種:   Escherichia coli K-12 (大腸菌) / 細胞中の位置: Cytoplasmic Membrane Escherichia coli K-12 (大腸菌) / 細胞中の位置: Cytoplasmic Membrane |
| 分子量 | 理論値: 17 KDa |
| 組換発現 | 生物種:   Escherichia coli BL21(DE3) (大腸菌) / 組換株: pLysS / 組換プラスミド: pETDuet-1 Escherichia coli BL21(DE3) (大腸菌) / 組換株: pLysS / 組換プラスミド: pETDuet-1 |
| 配列 | UniProtKB: Biopolymer transport protein ExbD / GO: membrane => GO:0016020 / InterPro: TonB system transport protein ExbD type-1 |
-分子 #3: Protein TonB
| 分子 | 名称: Protein TonB / タイプ: protein_or_peptide / ID: 3 / Name.synonym: TonB / コピー数: 1 / 集合状態: Monomer / 組換発現: Yes |
|---|---|
| 由来(天然) | 生物種:   Escherichia coli K-12 (大腸菌) / 細胞中の位置: Cytoplasmic Membrane Escherichia coli K-12 (大腸菌) / 細胞中の位置: Cytoplasmic Membrane |
| 分子量 | 理論値: 29 KDa |
| 組換発現 | 生物種:   Escherichia coli BL21(DE3) (大腸菌) / 組換株: pLysS / 組換プラスミド: pETDuet-1 Escherichia coli BL21(DE3) (大腸菌) / 組換株: pLysS / 組換プラスミド: pETDuet-1 |
| 配列 | UniProtKB: Protein TonB / GO: membrane => GO:0016020 / InterPro: TonB/TolA, C-terminal |
-実験情報
-構造解析
| 手法 |  ネガティブ染色法 ネガティブ染色法 |
|---|---|
 解析 解析 |  単粒子再構成法 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 緩衝液 | pH: 7.5 / 詳細: 25 mM Tris-HCl, 150 mM NaCl, 0.02% DDM |
|---|---|
| 染色 | タイプ: NEGATIVE 詳細: Grids with adsorbed protein were stained with 1.5% uranyl formate for 90 seconds. |
| グリッド | 詳細: 400 mesh copper grid with thin carbon support, glow discharged |
| 凍結 | 凍結剤: NONE / 装置: OTHER |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TECNAI F20 |
|---|---|
| 電子線 | 加速電圧: 200 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 倍率(補正後): 67147 / 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD Bright-field microscopy / Cs: 2.0 mm / 最大 デフォーカス(公称値): 3.0 µm / 最小 デフォーカス(公称値): 1.0 µm / 倍率(公称値): 67000 Bright-field microscopy / Cs: 2.0 mm / 最大 デフォーカス(公称値): 3.0 µm / 最小 デフォーカス(公称値): 1.0 µm / 倍率(公称値): 67000 |
| 試料ステージ | 試料ホルダー: Room temperature / 試料ホルダーモデル: SIDE ENTRY, EUCENTRIC |
| アライメント法 | Legacy - 非点収差: Objective lens astigmatism was corrected at 50,000x magnification |
| 日付 | 2014年4月22日 |
| 撮影 | カテゴリ: CCD フィルム・検出器のモデル: GATAN ULTRASCAN 4000 (4k x 4k) 平均電子線量: 20 e/Å2 |
| 実験機器 |  モデル: Tecnai F20 / 画像提供: FEI Company |
- 画像解析
画像解析
| CTF補正 | 詳細: Each Micrograph |
|---|---|
| 最終 再構成 | 想定した対称性 - 点群: C1 (非対称) / アルゴリズム: OTHER / 解像度のタイプ: BY AUTHOR / 解像度: 23.0 Å / 解像度の算出法: OTHER / ソフトウェア - 名称: Xmipp3.1, RELION1.3 / 使用した粒子像数: 12200 |
| 詳細 | Manual particle picking from random conical tilt pairs, 3D classification, projection matching angular refinement |
 ムービー
ムービー コントローラー
コントローラー