+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 7nip | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
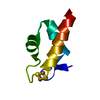
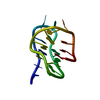
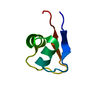
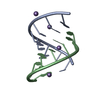
| タイトル | titin N2A unique sequence (UN2A) core | |||||||||
 要素 要素 | Isoform 11 of Titin | |||||||||
 キーワード キーワード |  STRUCTURAL PROTEIN (タンパク質) / STRUCTURAL PROTEIN (タンパク質) /  titin (チチン) / N2A / UN2A titin (チチン) / N2A / UN2A | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報sarcomerogenesis / structural molecule activity conferring elasticity /  telethonin binding / skeletal muscle myosin thick filament assembly / cardiac myofibril assembly / muscle alpha-actinin binding / detection of muscle stretch / cardiac muscle tissue morphogenesis / telethonin binding / skeletal muscle myosin thick filament assembly / cardiac myofibril assembly / muscle alpha-actinin binding / detection of muscle stretch / cardiac muscle tissue morphogenesis /  regulation of catalytic activity / cardiac muscle hypertrophy ...sarcomerogenesis / structural molecule activity conferring elasticity / regulation of catalytic activity / cardiac muscle hypertrophy ...sarcomerogenesis / structural molecule activity conferring elasticity /  telethonin binding / skeletal muscle myosin thick filament assembly / cardiac myofibril assembly / muscle alpha-actinin binding / detection of muscle stretch / cardiac muscle tissue morphogenesis / telethonin binding / skeletal muscle myosin thick filament assembly / cardiac myofibril assembly / muscle alpha-actinin binding / detection of muscle stretch / cardiac muscle tissue morphogenesis /  regulation of catalytic activity / cardiac muscle hypertrophy / mitotic chromosome condensation / Striated Muscle Contraction / regulation of catalytic activity / cardiac muscle hypertrophy / mitotic chromosome condensation / Striated Muscle Contraction /  M band / M band /  actinin binding / I band / cardiac muscle cell development / actinin binding / I band / cardiac muscle cell development /  regulation of protein kinase activity / structural constituent of muscle / sarcomere organization / skeletal muscle thin filament assembly / striated muscle thin filament / striated muscle contraction / protein kinase A signaling / cardiac muscle contraction / condensed nuclear chromosome / regulation of protein kinase activity / structural constituent of muscle / sarcomere organization / skeletal muscle thin filament assembly / striated muscle thin filament / striated muscle contraction / protein kinase A signaling / cardiac muscle contraction / condensed nuclear chromosome /  muscle contraction / positive regulation of protein secretion / Z disc / response to calcium ion / muscle contraction / positive regulation of protein secretion / Z disc / response to calcium ion /  : / : /  actin filament binding / Platelet degranulation / actin filament binding / Platelet degranulation /  protein tyrosine kinase activity / protein tyrosine kinase activity /  protease binding / protease binding /  calmodulin binding / calmodulin binding /  non-specific serine/threonine protein kinase / non-specific serine/threonine protein kinase /  リン酸化 / protein serine kinase activity / protein serine/threonine kinase activity / リン酸化 / protein serine kinase activity / protein serine/threonine kinase activity /  calcium ion binding / positive regulation of gene expression / calcium ion binding / positive regulation of gene expression /  protein kinase binding / protein kinase binding /  enzyme binding / extracellular exosome / extracellular region / enzyme binding / extracellular exosome / extracellular region /  ATP binding / identical protein binding / ATP binding / identical protein binding /  細胞質基質 細胞質基質類似検索 - 分子機能 | |||||||||
| 生物種 |   Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||
| 手法 |  溶液NMR / na 溶液NMR / na | |||||||||
 データ登録者 データ登録者 | Zhou, T. / Kovermann, M. / Fleming, J.R. / Mayans, O. | |||||||||
| 資金援助 |  フランス, European Union, 2件 フランス, European Union, 2件
| |||||||||
 引用 引用 |  ジャーナル: J.Mol.Biol. / 年: 2021 ジャーナル: J.Mol.Biol. / 年: 2021タイトル: Molecular Characterisation of Titin N2A and Its Binding of CARP Reveals a Titin/Actin Cross-linking Mechanism. 著者: Zhou, T. / Fleming, J.R. / Lange, S. / Hessel, A.L. / Bogomolovas, J. / Stronczek, C. / Grundei, D. / Ghassemian, M. / Biju, A. / Borgeson, E. / Bullard, B. / Linke, W.A. / Chen, J. / Kovermann, M. / Mayans, O. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  7nip.cif.gz 7nip.cif.gz | 133.4 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb7nip.ent.gz pdb7nip.ent.gz | 114.3 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  7nip.json.gz 7nip.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/ni/7nip https://data.pdbj.org/pub/pdb/validation_reports/ni/7nip ftp://data.pdbj.org/pub/pdb/validation_reports/ni/7nip ftp://data.pdbj.org/pub/pdb/validation_reports/ni/7nip | HTTPS FTP |
|---|
-関連構造データ
| 類似構造データ | |
|---|---|
| その他のデータベース |
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
| |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| 1 |
| |||||||||
| NMR アンサンブル |
|
- 要素
要素
| #1: タンパク質・ペプチド | 分子量: 4932.733 Da / 分子数: 1 / 由来タイプ: 組換発現 / 由来: (組換発現)   Homo sapiens (ヒト) / 遺伝子: TTN / 発現宿主: Homo sapiens (ヒト) / 遺伝子: TTN / 発現宿主:   Escherichia coli (大腸菌) Escherichia coli (大腸菌)参照: UniProt: Q8WZ42,  non-specific serine/threonine protein kinase non-specific serine/threonine protein kinase |
|---|
-実験情報
-実験
| 実験 | 手法:  溶液NMR 溶液NMR | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| NMR実験 |
|
- 試料調製
試料調製
| 詳細 | タイプ: solution 内容: 30 mM sodium phosphate, 100 mM sodium chloride, 95% H2O/5% D2O Label: sample_un2a / 溶媒系: 95% H2O/5% D2O | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 試料 |
| ||||||||||||
| 試料状態 | イオン強度: 100 mM / Label: conditions_1 / pH: 7.5 / 圧: 101300 Pa / 温度: 298 K |
-NMR測定
| NMRスペクトロメーター | タイプ: Bruker AVANCE III / 製造業者: Bruker / モデル : AVANCE III / 磁場強度: 600 MHz : AVANCE III / 磁場強度: 600 MHz |
|---|
- 解析
解析
| NMR software |
| ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 精密化 | 手法: na / ソフトェア番号: 1 | ||||||||||||||||
| 代表構造 | 選択基準: closest to the average | ||||||||||||||||
| NMRアンサンブル | コンフォーマー選択の基準: all calculated structures submitted 計算したコンフォーマーの数: 32500 / 登録したコンフォーマーの数: 10 |
 ムービー
ムービー コントローラー
コントローラー







 PDBj
PDBj



