| 登録情報 | データベース: PDB / ID: 7m10
|
|---|
| タイトル | PHF2 PHD Domain Complexed with Peptide From N-terminus of VRK1 |
|---|
 要素 要素 | - Lysine-specific demethylase PHF2
- Serine/threonine-protein kinase VRK1 N-terminus peptide
|
|---|
 キーワード キーワード |  PROTEIN BINDING (タンパク質) / PROTEIN BINDING (タンパク質) /  PHD FINGER / METAL-BINDING / PHD FINGER / METAL-BINDING /  ZINC-FINGER (ジンクフィンガー) / HISTONE-BINDING / NON-HISTONE BINDING ZINC-FINGER (ジンクフィンガー) / HISTONE-BINDING / NON-HISTONE BINDING |
|---|
| 機能・相同性 |  機能・相同性情報 機能・相同性情報
histone H4K20 demethylase activity / Golgi disassembly / histone H3T3 kinase activity / negative regulation of rDNA heterochromatin formation / Nuclear Envelope Breakdown / positive regulation of protein localization to chromatin / mitotic nuclear membrane disassembly /  酸化還元酵素; 電子対供与作用を持つ; 分子酸素を取り込むないしは分子酸素を還元する; 2-オキソグルタル酸類を片方の電子供与体とする; 酸素分をそれぞれの電子供与体に取り込む / protein demethylation / 酸化還元酵素; 電子対供与作用を持つ; 分子酸素を取り込むないしは分子酸素を還元する; 2-オキソグルタル酸類を片方の電子供与体とする; 酸素分をそれぞれの電子供与体に取り込む / protein demethylation /  ゴルジ体 ...histone H4K20 demethylase activity / Golgi disassembly / histone H3T3 kinase activity / negative regulation of rDNA heterochromatin formation / Nuclear Envelope Breakdown / positive regulation of protein localization to chromatin / mitotic nuclear membrane disassembly / ゴルジ体 ...histone H4K20 demethylase activity / Golgi disassembly / histone H3T3 kinase activity / negative regulation of rDNA heterochromatin formation / Nuclear Envelope Breakdown / positive regulation of protein localization to chromatin / mitotic nuclear membrane disassembly /  酸化還元酵素; 電子対供与作用を持つ; 分子酸素を取り込むないしは分子酸素を還元する; 2-オキソグルタル酸類を片方の電子供与体とする; 酸素分をそれぞれの電子供与体に取り込む / protein demethylation / 酸化還元酵素; 電子対供与作用を持つ; 分子酸素を取り込むないしは分子酸素を還元する; 2-オキソグルタル酸類を片方の電子供与体とする; 酸素分をそれぞれの電子供与体に取り込む / protein demethylation /  ゴルジ体 / Initiation of Nuclear Envelope (NE) Reformation / histone H3S10 kinase activity / histone H3K9 demethylase activity / transcription initiation-coupled chromatin remodeling / methylated histone binding / liver development / ゴルジ体 / Initiation of Nuclear Envelope (NE) Reformation / histone H3S10 kinase activity / histone H3K9 demethylase activity / transcription initiation-coupled chromatin remodeling / methylated histone binding / liver development /  transcription coregulator activity / HDMs demethylate histones / transcription coregulator activity / HDMs demethylate histones /  動原体 / 動原体 /  kinase activity / kinase activity /  histone binding / protein autophosphorylation / histone binding / protein autophosphorylation /  transcription coactivator activity / transcription coactivator activity /  non-specific serine/threonine protein kinase / non-specific serine/threonine protein kinase /  protein kinase activity / iron ion binding / protein kinase activity / iron ion binding /  細胞分裂 / 細胞分裂 /  protein phosphorylation / protein serine kinase activity / protein serine/threonine kinase activity / DNA damage response / protein phosphorylation / protein serine kinase activity / protein serine/threonine kinase activity / DNA damage response /  核小体 / regulation of transcription by RNA polymerase II / 核小体 / regulation of transcription by RNA polymerase II /  protein kinase binding / protein kinase binding /  シグナル伝達 / zinc ion binding / シグナル伝達 / zinc ion binding /  核質 / 核質 /  ATP binding / ATP binding /  細胞核 / 細胞核 /  細胞質基質類似検索 - 分子機能 細胞質基質類似検索 - 分子機能 Jumonji, helical domain / Jumonji helical domain / JmjC domain, hydroxylase / A domain family that is part of the cupin metalloenzyme superfamily. / JmjC domain / JmjC domain profile. /  Zinc finger, PHD-type, conserved site / PHD-finger / Zinc finger PHD-type signature. / Zinc finger PHD-type profile. ...Jumonji, helical domain / Jumonji helical domain / JmjC domain, hydroxylase / A domain family that is part of the cupin metalloenzyme superfamily. / JmjC domain / JmjC domain profile. / Zinc finger, PHD-type, conserved site / PHD-finger / Zinc finger PHD-type signature. / Zinc finger PHD-type profile. ...Jumonji, helical domain / Jumonji helical domain / JmjC domain, hydroxylase / A domain family that is part of the cupin metalloenzyme superfamily. / JmjC domain / JmjC domain profile. /  Zinc finger, PHD-type, conserved site / PHD-finger / Zinc finger PHD-type signature. / Zinc finger PHD-type profile. / Zinc finger, PHD-type, conserved site / PHD-finger / Zinc finger PHD-type signature. / Zinc finger PHD-type profile. /  Zinc finger, PHD-finger / Zinc finger, PHD-finger /  Zinc finger, PHD-type / PHD zinc finger / Zinc finger, PHD-type / PHD zinc finger /  Zinc finger, FYVE/PHD-type / Zinc finger, FYVE/PHD-type /  Zinc finger, RING/FYVE/PHD-type / Zinc finger, RING/FYVE/PHD-type /  Serine/threonine-protein kinase, active site / Serine/threonine-protein kinase, active site /  Serine/Threonine protein kinases active-site signature. / Serine/Threonine protein kinases active-site signature. /  Protein kinase domain / Protein kinase domain /  Serine/Threonine protein kinases, catalytic domain / Serine/Threonine protein kinases, catalytic domain /  Protein kinase, ATP binding site / Protein kinases ATP-binding region signature. / Protein kinase domain profile. / Protein kinase, ATP binding site / Protein kinases ATP-binding region signature. / Protein kinase domain profile. /  Protein kinase domain / Protein kinase-like domain superfamily類似検索 - ドメイン・相同性 Protein kinase domain / Protein kinase-like domain superfamily類似検索 - ドメイン・相同性  ギ酸 / Lysine-specific demethylase PHF2 / Serine/threonine-protein kinase VRK1類似検索 - 構成要素 ギ酸 / Lysine-specific demethylase PHF2 / Serine/threonine-protein kinase VRK1類似検索 - 構成要素 |
|---|
| 生物種 |   Homo sapiens (ヒト) Homo sapiens (ヒト) |
|---|
| 手法 |  X線回折 / X線回折 /  シンクロトロン / シンクロトロン /  分子置換 / 解像度: 1.15 Å 分子置換 / 解像度: 1.15 Å |
|---|
 データ登録者 データ登録者 | Horton, J.R. / Cheng, X. |
|---|
| 資金援助 |  米国, 1件 米国, 1件 | 組織 | 認可番号 | 国 |
|---|
| National Institutes of Health/National Institute of General Medical Sciences (NIH/NIGMS) | GM049245-23 |  米国 米国 |
|
|---|
 引用 引用 |  ジャーナル: Biochem.J. / 年: 2021 ジャーナル: Biochem.J. / 年: 2021
タイトル: Histone H3 N-terminal mimicry drives a novel network of methyl-effector interactions.
著者: Chen, J. / Horton, J. / Sagum, C. / Zhou, J. / Cheng, X. / Bedford, M.T. |
|---|
| 履歴 | | 登録 | 2021年3月11日 | 登録サイト: RCSB / 処理サイト: RCSB |
|---|
| 改定 1.0 | 2021年5月26日 | Provider: repository / タイプ: Initial release |
|---|
| 改定 1.1 | 2021年6月9日 | Group: Database references / カテゴリ: citation
Item: _citation.journal_volume / _citation.page_first / _citation.page_last |
|---|
| 改定 1.2 | 2023年10月18日 | Group: Data collection / Database references / Refinement description
カテゴリ: chem_comp_atom / chem_comp_bond ...chem_comp_atom / chem_comp_bond / database_2 / pdbx_initial_refinement_model
Item: _database_2.pdbx_DOI / _database_2.pdbx_database_accession |
|---|
|
|---|
 データを開く
データを開く 基本情報
基本情報 要素
要素 キーワード
キーワード PROTEIN BINDING (タンパク質) /
PROTEIN BINDING (タンパク質) /  PHD FINGER / METAL-BINDING /
PHD FINGER / METAL-BINDING /  ZINC-FINGER (ジンクフィンガー) / HISTONE-BINDING / NON-HISTONE BINDING
ZINC-FINGER (ジンクフィンガー) / HISTONE-BINDING / NON-HISTONE BINDING 機能・相同性情報
機能・相同性情報 酸化還元酵素; 電子対供与作用を持つ; 分子酸素を取り込むないしは分子酸素を還元する; 2-オキソグルタル酸類を片方の電子供与体とする; 酸素分をそれぞれの電子供与体に取り込む / protein demethylation /
酸化還元酵素; 電子対供与作用を持つ; 分子酸素を取り込むないしは分子酸素を還元する; 2-オキソグルタル酸類を片方の電子供与体とする; 酸素分をそれぞれの電子供与体に取り込む / protein demethylation /  ゴルジ体 ...histone H4K20 demethylase activity / Golgi disassembly / histone H3T3 kinase activity / negative regulation of rDNA heterochromatin formation / Nuclear Envelope Breakdown / positive regulation of protein localization to chromatin / mitotic nuclear membrane disassembly /
ゴルジ体 ...histone H4K20 demethylase activity / Golgi disassembly / histone H3T3 kinase activity / negative regulation of rDNA heterochromatin formation / Nuclear Envelope Breakdown / positive regulation of protein localization to chromatin / mitotic nuclear membrane disassembly /  酸化還元酵素; 電子対供与作用を持つ; 分子酸素を取り込むないしは分子酸素を還元する; 2-オキソグルタル酸類を片方の電子供与体とする; 酸素分をそれぞれの電子供与体に取り込む / protein demethylation /
酸化還元酵素; 電子対供与作用を持つ; 分子酸素を取り込むないしは分子酸素を還元する; 2-オキソグルタル酸類を片方の電子供与体とする; 酸素分をそれぞれの電子供与体に取り込む / protein demethylation /  ゴルジ体 / Initiation of Nuclear Envelope (NE) Reformation / histone H3S10 kinase activity / histone H3K9 demethylase activity / transcription initiation-coupled chromatin remodeling / methylated histone binding / liver development /
ゴルジ体 / Initiation of Nuclear Envelope (NE) Reformation / histone H3S10 kinase activity / histone H3K9 demethylase activity / transcription initiation-coupled chromatin remodeling / methylated histone binding / liver development /  transcription coregulator activity / HDMs demethylate histones /
transcription coregulator activity / HDMs demethylate histones /  動原体 /
動原体 /  kinase activity /
kinase activity /  histone binding / protein autophosphorylation /
histone binding / protein autophosphorylation /  transcription coactivator activity /
transcription coactivator activity /  non-specific serine/threonine protein kinase /
non-specific serine/threonine protein kinase /  protein kinase activity / iron ion binding /
protein kinase activity / iron ion binding /  細胞分裂 /
細胞分裂 /  protein phosphorylation / protein serine kinase activity / protein serine/threonine kinase activity / DNA damage response /
protein phosphorylation / protein serine kinase activity / protein serine/threonine kinase activity / DNA damage response /  核小体 / regulation of transcription by RNA polymerase II /
核小体 / regulation of transcription by RNA polymerase II /  protein kinase binding /
protein kinase binding /  シグナル伝達 / zinc ion binding /
シグナル伝達 / zinc ion binding /  核質 /
核質 /  ATP binding /
ATP binding /  細胞核 /
細胞核 /  細胞質基質
細胞質基質
 Homo sapiens (ヒト)
Homo sapiens (ヒト) X線回折 /
X線回折 /  シンクロトロン /
シンクロトロン /  分子置換 / 解像度: 1.15 Å
分子置換 / 解像度: 1.15 Å  データ登録者
データ登録者 米国, 1件
米国, 1件  引用
引用 ジャーナル: Biochem.J. / 年: 2021
ジャーナル: Biochem.J. / 年: 2021 構造の表示
構造の表示 Molmil
Molmil Jmol/JSmol
Jmol/JSmol ダウンロードとリンク
ダウンロードとリンク ダウンロード
ダウンロード 7m10.cif.gz
7m10.cif.gz PDBx/mmCIF形式
PDBx/mmCIF形式 pdb7m10.ent.gz
pdb7m10.ent.gz PDB形式
PDB形式 7m10.json.gz
7m10.json.gz PDBx/mmJSON形式
PDBx/mmJSON形式 その他のダウンロード
その他のダウンロード https://data.pdbj.org/pub/pdb/validation_reports/m1/7m10
https://data.pdbj.org/pub/pdb/validation_reports/m1/7m10 ftp://data.pdbj.org/pub/pdb/validation_reports/m1/7m10
ftp://data.pdbj.org/pub/pdb/validation_reports/m1/7m10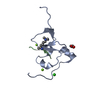
 リンク
リンク 集合体
集合体
 要素
要素
 Homo sapiens (ヒト) / 遺伝子: PHF2, CENP-35, KIAA0662 / 発現宿主:
Homo sapiens (ヒト) / 遺伝子: PHF2, CENP-35, KIAA0662 / 発現宿主: 
 Escherichia coli BL21(DE3) (大腸菌) / Variant (発現宿主): Gold plus
Escherichia coli BL21(DE3) (大腸菌) / Variant (発現宿主): Gold plus 酸化還元酵素; 電子対供与作用を持つ; 分子酸素を取り込むないしは分子酸素を還元する; 2-オキソグルタル酸類を片方の電子供与体とする; 酸素分をそれぞれの電子供与体に取り込む
酸化還元酵素; 電子対供与作用を持つ; 分子酸素を取り込むないしは分子酸素を還元する; 2-オキソグルタル酸類を片方の電子供与体とする; 酸素分をそれぞれの電子供与体に取り込む
 Homo sapiens (ヒト)
Homo sapiens (ヒト) non-specific serine/threonine protein kinase
non-specific serine/threonine protein kinase ギ酸
ギ酸 水
水 X線回折 / 使用した結晶の数: 1
X線回折 / 使用した結晶の数: 1  試料調製
試料調製
 シンクロトロン / サイト:
シンクロトロン / サイト:  APS
APS  / ビームライン: 22-ID / 波長: 1 Å
/ ビームライン: 22-ID / 波長: 1 Å : 1 Å / 相対比: 1
: 1 Å / 相対比: 1  解析
解析 :
:  分子置換
分子置換 ムービー
ムービー コントローラー
コントローラー











 PDBj
PDBj







