+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 6vcu | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Homo sapiens FKBP12 protein bound with APX879 in P32 space group | |||||||||
 要素 要素 | Peptidyl-prolyl cis-trans isomerase FKBP1A | |||||||||
 キーワード キーワード |  ISOMERASE (異性化酵素) / FK506-binding protein 1A / ISOMERASE (異性化酵素) / FK506-binding protein 1A /  FKBP12 / FKBP12 /  FK506 (タクロリムス) FK506 (タクロリムス) | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報 macrolide binding / macrolide binding /  activin receptor binding / cytoplasmic side of membrane / signaling receptor inhibitor activity / activin receptor binding / cytoplasmic side of membrane / signaling receptor inhibitor activity /  transforming growth factor beta receptor binding / TGFBR1 LBD Mutants in Cancer / type I transforming growth factor beta receptor binding / negative regulation of activin receptor signaling pathway / heart trabecula formation / transforming growth factor beta receptor binding / TGFBR1 LBD Mutants in Cancer / type I transforming growth factor beta receptor binding / negative regulation of activin receptor signaling pathway / heart trabecula formation /  terminal cisterna ... terminal cisterna ... macrolide binding / macrolide binding /  activin receptor binding / cytoplasmic side of membrane / signaling receptor inhibitor activity / activin receptor binding / cytoplasmic side of membrane / signaling receptor inhibitor activity /  transforming growth factor beta receptor binding / TGFBR1 LBD Mutants in Cancer / type I transforming growth factor beta receptor binding / negative regulation of activin receptor signaling pathway / heart trabecula formation / transforming growth factor beta receptor binding / TGFBR1 LBD Mutants in Cancer / type I transforming growth factor beta receptor binding / negative regulation of activin receptor signaling pathway / heart trabecula formation /  terminal cisterna / terminal cisterna /  ryanodine receptor complex / ryanodine receptor complex /  I-SMAD binding / regulation of amyloid precursor protein catabolic process / protein maturation by protein folding / 'de novo' protein folding / ventricular cardiac muscle tissue morphogenesis / negative regulation of phosphoprotein phosphatase activity / I-SMAD binding / regulation of amyloid precursor protein catabolic process / protein maturation by protein folding / 'de novo' protein folding / ventricular cardiac muscle tissue morphogenesis / negative regulation of phosphoprotein phosphatase activity /  FK506 binding / mTORC1-mediated signalling / TGF-beta receptor signaling activates SMADs / Calcineurin activates NFAT / FK506 binding / mTORC1-mediated signalling / TGF-beta receptor signaling activates SMADs / Calcineurin activates NFAT /  regulation of immune response / protein peptidyl-prolyl isomerization / supramolecular fiber organization / heart morphogenesis / regulation of ryanodine-sensitive calcium-release channel activity / sarcoplasmic reticulum membrane / regulation of immune response / protein peptidyl-prolyl isomerization / supramolecular fiber organization / heart morphogenesis / regulation of ryanodine-sensitive calcium-release channel activity / sarcoplasmic reticulum membrane /  T細胞 / TGF-beta receptor signaling in EMT (epithelial to mesenchymal transition) / T細胞 / TGF-beta receptor signaling in EMT (epithelial to mesenchymal transition) /  筋小胞体 / 筋小胞体 /  プロリルイソメラーゼ / プロリルイソメラーゼ /  peptidyl-prolyl cis-trans isomerase activity / calcium ion transmembrane transport / negative regulation of transforming growth factor beta receptor signaling pathway / Z disc / SARS-CoV-1 activates/modulates innate immune responses / peptidyl-prolyl cis-trans isomerase activity / calcium ion transmembrane transport / negative regulation of transforming growth factor beta receptor signaling pathway / Z disc / SARS-CoV-1 activates/modulates innate immune responses /  regulation of protein localization / regulation of protein localization /  フォールディング / positive regulation of protein binding / protein refolding / positive regulation of canonical NF-kappaB signal transduction / transmembrane transporter binding / Potential therapeutics for SARS / amyloid fibril formation / フォールディング / positive regulation of protein binding / protein refolding / positive regulation of canonical NF-kappaB signal transduction / transmembrane transporter binding / Potential therapeutics for SARS / amyloid fibril formation /  生体膜 / 生体膜 /  細胞質基質 / 細胞質基質 /  細胞質 細胞質類似検索 - 分子機能 | |||||||||
| 生物種 |   Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||
| 手法 |  X線回折 / X線回折 /  シンクロトロン / シンクロトロン /  分子置換 / 解像度: 1.69 Å 分子置換 / 解像度: 1.69 Å | |||||||||
 データ登録者 データ登録者 | Gobeil, S. / Spicer, L. | |||||||||
| 資金援助 |  米国, 2件 米国, 2件
| |||||||||
 引用 引用 |  ジャーナル: Mbio / 年: 2021 ジャーナル: Mbio / 年: 2021タイトル: Leveraging Fungal and Human Calcineurin-Inhibitor Structures, Biophysical Data, and Dynamics To Design Selective and Nonimmunosuppressive FK506 Analogs. 著者: Gobeil, S.M. / Bobay, B.G. / Juvvadi, P.R. / Cole, D.C. / Heitman, J. / Steinbach, W.J. / Venters, R.A. / Spicer, L.D. #1:  ジャーナル: Biorxiv / 年: 2020 ジャーナル: Biorxiv / 年: 2020タイトル: Designing Selective and Non-Immunosuppressive Antifungal FK506 Analogs: Structures, Biophysics and Dynamics of Fungal and Human Calcineurin-Inhibitor Complexes 著者: Gobeil, S.M. / Bobay, B.G. / Juvvadi, P.R. / Cole, D.C. / Heitman, J. / Steinbach, W.J. / Venters, R.A. / Spicer, L.D. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  6vcu.cif.gz 6vcu.cif.gz | 152.5 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb6vcu.ent.gz pdb6vcu.ent.gz | 98.3 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  6vcu.json.gz 6vcu.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/vc/6vcu https://data.pdbj.org/pub/pdb/validation_reports/vc/6vcu ftp://data.pdbj.org/pub/pdb/validation_reports/vc/6vcu ftp://data.pdbj.org/pub/pdb/validation_reports/vc/6vcu | HTTPS FTP |
|---|
-関連構造データ
| 関連構造データ |  6vctC  6vcvC  6vrxC  2ppnS S: 精密化の開始モデル C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | |
| その他のデータベース |
|
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
| ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 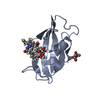
| ||||||||||||
| 2 | 
| ||||||||||||
| 3 | 
| ||||||||||||
| 4 | 
| ||||||||||||
| 単位格子 |
|
- 要素
要素
| #1: タンパク質 | 分子量: 12249.980 Da / 分子数: 4 / 由来タイプ: 組換発現 / 由来: (組換発現)   Homo sapiens (ヒト) / 遺伝子: FKBP1A, FKBP1, FKBP12 / 発現宿主: Homo sapiens (ヒト) / 遺伝子: FKBP1A, FKBP1, FKBP12 / 発現宿主:   Escherichia coli BL21(DE3) (大腸菌) / 参照: UniProt: P62942, Escherichia coli BL21(DE3) (大腸菌) / 参照: UniProt: P62942,  プロリルイソメラーゼ プロリルイソメラーゼ#2: 化合物 | ChemComp-ACT /  酢酸塩 酢酸塩#3: 化合物 | ChemComp-R27 / #4: 水 | ChemComp-HOH / |  水 水研究の焦点であるリガンドがあるか | Y | |
|---|
-実験情報
-実験
| 実験 | 手法:  X線回折 / 使用した結晶の数: 1 X線回折 / 使用した結晶の数: 1 |
|---|
- 試料調製
試料調製
| 結晶 | マシュー密度: 2.2 Å3/Da / 溶媒含有率: 44.03 % |
|---|---|
結晶化 | 温度: 293 K / 手法: 蒸気拡散法, ハンギングドロップ法 / pH: 4.6 詳細: 2.5M Ammonium sulfate, 0.1M Sodium acetate trihydrate |
-データ収集
| 回折 | 平均測定温度: 93 K / Serial crystal experiment: N |
|---|---|
| 放射光源 | 由来:  シンクロトロン / サイト: シンクロトロン / サイト:  APS APS  / ビームライン: 22-BM / 波長: 1 Å / ビームライン: 22-BM / 波長: 1 Å |
| 検出器 | タイプ: RAYONIX MX300-HS / 検出器: CCD / 日付: 2019年4月21日 |
| 放射 | モノクロメーター: 1 / プロトコル: SINGLE WAVELENGTH / 単色(M)・ラウエ(L): M / 散乱光タイプ: x-ray |
| 放射波長 | 波長 : 1 Å / 相対比: 1 : 1 Å / 相対比: 1 |
| 反射 | 解像度: 1.69→50 Å / Num. obs: 45479 / % possible obs: 100 % / 冗長度: 6.5 % / Biso Wilson estimate: 12.72 Å2 / CC1/2: 0.985 / Rpim(I) all: 0.053 / Rrim(I) all: 0.135 / Rsym value: 0.125 / Net I/σ(I): 30.5 |
| 反射 シェル | 解像度: 1.69→1.72 Å / 冗長度: 6.2 % / Mean I/σ(I) obs: 5.7 / Num. unique obs: 2284 / CC1/2: 0.94 / Rpim(I) all: 0.139 / Rrim(I) all: 0.349 / Rsym value: 0.32 / % possible all: 100 |
- 解析
解析
| ソフトウェア |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 精密化 | 構造決定の手法 : :  分子置換 分子置換開始モデル: 2PPN 解像度: 1.69→31.26 Å / SU ML: 0.1555 / 交差検証法: FREE R-VALUE / σ(F): 2.05 / 位相誤差: 18.2937 立体化学のターゲット値: GeoStd + Monomer Library + CDL v1.2
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 溶媒の処理 | 減衰半径: 0.9 Å / VDWプローブ半径: 1.11 Å / 溶媒モデル: FLAT BULK SOLVENT MODEL | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子変位パラメータ | Biso mean: 15.68 Å2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化ステップ | サイクル: LAST / 解像度: 1.69→31.26 Å
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 拘束条件 |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| LS精密化 シェル |
|
 ムービー
ムービー コントローラー
コントローラー













 PDBj
PDBj












