+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 6ut2 | ||||||
|---|---|---|---|---|---|---|---|
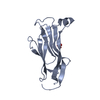
| タイトル | 3D structure of the leiomodin/tropomyosin binding interface | ||||||
 要素 要素 |
| ||||||
 キーワード キーワード |  STRUCTURAL PROTEIN (タンパク質) / pointed end / thin filaments STRUCTURAL PROTEIN (タンパク質) / pointed end / thin filaments | ||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報pointed-end actin filament capping / positive regulation of heart rate by epinephrine / muscle thin filament tropomyosin /  myofibril assembly / actin nucleation / bleb / negative regulation of vascular associated smooth muscle cell migration / myofibril assembly / actin nucleation / bleb / negative regulation of vascular associated smooth muscle cell migration /  regulation of muscle contraction / muscle filament sliding / ruffle organization ...pointed-end actin filament capping / positive regulation of heart rate by epinephrine / muscle thin filament tropomyosin / regulation of muscle contraction / muscle filament sliding / ruffle organization ...pointed-end actin filament capping / positive regulation of heart rate by epinephrine / muscle thin filament tropomyosin /  myofibril assembly / actin nucleation / bleb / negative regulation of vascular associated smooth muscle cell migration / myofibril assembly / actin nucleation / bleb / negative regulation of vascular associated smooth muscle cell migration /  regulation of muscle contraction / muscle filament sliding / ruffle organization / positive regulation of ATP-dependent activity / Striated Muscle Contraction / regulation of muscle contraction / muscle filament sliding / ruffle organization / positive regulation of ATP-dependent activity / Striated Muscle Contraction /  M band / M band /  regulation of heart contraction / sarcomere organization / structural constituent of muscle / ventricular cardiac muscle tissue morphogenesis / regulation of heart contraction / sarcomere organization / structural constituent of muscle / ventricular cardiac muscle tissue morphogenesis /  myofibril / myofibril /  tropomyosin binding / positive regulation of actin filament polymerization / negative regulation of vascular associated smooth muscle cell proliferation / striated muscle thin filament / actin monomer binding / positive regulation of cell adhesion / Smooth Muscle Contraction / tropomyosin binding / positive regulation of actin filament polymerization / negative regulation of vascular associated smooth muscle cell proliferation / striated muscle thin filament / actin monomer binding / positive regulation of cell adhesion / Smooth Muscle Contraction /  stress fiber / cardiac muscle contraction / positive regulation of stress fiber assembly / cytoskeleton organization / actin filament polymerization / stress fiber / cardiac muscle contraction / positive regulation of stress fiber assembly / cytoskeleton organization / actin filament polymerization /  cytoskeletal protein binding / cytoskeletal protein binding /  sarcomere / negative regulation of cell migration / sarcomere / negative regulation of cell migration /  muscle contraction / actin filament organization / muscle contraction / actin filament organization /  マイクロフィラメント / マイクロフィラメント /  wound healing / structural constituent of cytoskeleton / ruffle membrane / cellular response to reactive oxygen species / wound healing / structural constituent of cytoskeleton / ruffle membrane / cellular response to reactive oxygen species /  actin filament binding / actin filament binding /  マイクロフィラメント / マイクロフィラメント /  actin binding / regulation of cell shape / actin binding / regulation of cell shape /  細胞骨格 / protein heterodimerization activity / protein homodimerization activity / identical protein binding / 細胞骨格 / protein heterodimerization activity / protein homodimerization activity / identical protein binding /  細胞質基質 細胞質基質類似検索 - 分子機能 | ||||||
| 生物種 |   Homo sapiens (ヒト) Homo sapiens (ヒト) | ||||||
| 手法 |  溶液NMR / 溶液NMR /  molecular dynamics molecular dynamics | ||||||
 データ登録者 データ登録者 | Tolkatchev, D. / Smith, G.E. / Helms, G.L. / Cort, J.R. / Kostyukova, A.S. | ||||||
| 資金援助 |  米国, 1件 米国, 1件
| ||||||
 引用 引用 |  ジャーナル: Plos Biol. / 年: 2020 ジャーナル: Plos Biol. / 年: 2020タイトル: Leiomodin creates a leaky cap at the pointed end of actin-thin filaments. 著者: Tolkatchev, D. / Smith Jr., G.E. / Schultz, L.E. / Colpan, M. / Helms, G.L. / Cort, J.R. / Gregorio, C.C. / Kostyukova, A.S. | ||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  6ut2.cif.gz 6ut2.cif.gz | 344.1 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb6ut2.ent.gz pdb6ut2.ent.gz | 292.1 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  6ut2.json.gz 6ut2.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/ut/6ut2 https://data.pdbj.org/pub/pdb/validation_reports/ut/6ut2 ftp://data.pdbj.org/pub/pdb/validation_reports/ut/6ut2 ftp://data.pdbj.org/pub/pdb/validation_reports/ut/6ut2 | HTTPS FTP |
|---|
-関連構造データ
| 類似構造データ | |
|---|---|
| その他のデータベース |
|
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
| |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| 1 |
| |||||||||
| NMR アンサンブル |
|
- 要素
要素
| #1: タンパク質・ペプチド | 分子量: 4669.050 Da / 分子数: 1 / 由来タイプ: 組換発現 / 由来: (組換発現)   Homo sapiens (ヒト) / 遺伝子: LMOD2 / 発現宿主: Homo sapiens (ヒト) / 遺伝子: LMOD2 / 発現宿主:   Escherichia coli BL21(DE3) (大腸菌) / 株 (発現宿主): BL21(DE3) / 参照: UniProt: Q6P5Q4 Escherichia coli BL21(DE3) (大腸菌) / 株 (発現宿主): BL21(DE3) / 参照: UniProt: Q6P5Q4 |
|---|---|
| #2: タンパク質・ペプチド | 分子量: 3909.709 Da / 分子数: 2 / 由来タイプ: 組換発現 / 由来: (組換発現)   Homo sapiens (ヒト) / 遺伝子: TPM1, C15orf13, TMSA / 発現宿主: Homo sapiens (ヒト) / 遺伝子: TPM1, C15orf13, TMSA / 発現宿主:   Escherichia coli BL21(DE3) (大腸菌) / 株 (発現宿主): BL21(DE3) / 参照: UniProt: P09493 Escherichia coli BL21(DE3) (大腸菌) / 株 (発現宿主): BL21(DE3) / 参照: UniProt: P09493 |
-実験情報
-実験
| 実験 | 手法:  溶液NMR 溶液NMR | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| NMR実験 |
|
- 試料調製
試料調製
| 詳細 |
| ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 試料 |
| ||||||||||||||||||||||||||||||||||||
| 試料状態 | 詳細: 50 mM sodium phosphate; 0.01% sodium azide; 0.2 mM ethylenediaminetetraacetate; 1x cOmplete, Mini, EDTA-free Protease Inhibitor Cocktail (Roche) イオン強度: 0.081 M / Ionic strength err: 0.002 / Label: conditions_1 / pH: 6.5 / PH err: 0.1 / 圧: 1 atm / 温度: 298 K |
-NMR測定
| NMRスペクトロメーター |
|
|---|
- 解析
解析
| NMR software |
| ||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 精密化 | 手法:  molecular dynamics / ソフトェア番号: 1 molecular dynamics / ソフトェア番号: 1 | ||||||||||||||||||||
| 代表構造 | 選択基準: closest to the average | ||||||||||||||||||||
| NMRアンサンブル | コンフォーマー選択の基準: structures with acceptable covalent geometry 計算したコンフォーマーの数: 20 / 登録したコンフォーマーの数: 10 |
 ムービー
ムービー コントローラー
コントローラー










 PDBj
PDBj



