| 登録情報 | データベース: PDB / ID: 6nn4
|
|---|
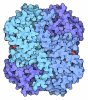
| タイトル | The structure of human liver pyruvate kinase, hLPYK-D499N, in complex with Fru-1,6-BP |
|---|
 要素 要素 | Pyruvate kinase PKLR |
|---|
 キーワード キーワード |  TRANSFERASE (転移酵素) / TRANSFERASE (転移酵素) /  pyruvate kinase (ピルビン酸キナーゼ) / pyruvate kinase (ピルビン酸キナーゼ) /  allosteric (アロステリック効果) / allosteric (アロステリック効果) /  glycolysis (解糖系) glycolysis (解糖系) |
|---|
| 機能・相同性 |  機能・相同性情報 機能・相同性情報
 pyruvate kinase complex / pyruvate biosynthetic process / SARS-CoV-1-host interactions / ChREBP activates metabolic gene expression / pyruvate kinase complex / pyruvate biosynthetic process / SARS-CoV-1-host interactions / ChREBP activates metabolic gene expression /  ピルビン酸キナーゼ / ピルビン酸キナーゼ /  pyruvate kinase activity / response to metal ion / pyruvate kinase activity / response to metal ion /  monosaccharide binding / monosaccharide binding /  解糖系 / response to ATP ... 解糖系 / response to ATP ... pyruvate kinase complex / pyruvate biosynthetic process / SARS-CoV-1-host interactions / ChREBP activates metabolic gene expression / pyruvate kinase complex / pyruvate biosynthetic process / SARS-CoV-1-host interactions / ChREBP activates metabolic gene expression /  ピルビン酸キナーゼ / ピルビン酸キナーゼ /  pyruvate kinase activity / response to metal ion / pyruvate kinase activity / response to metal ion /  monosaccharide binding / monosaccharide binding /  解糖系 / response to ATP / 解糖系 / response to ATP /  potassium ion binding / potassium ion binding /  Regulation of gene expression in beta cells / response to glucose / response to cAMP / cellular response to epinephrine stimulus / response to nutrient / glycolytic process / cellular response to insulin stimulus / Regulation of gene expression in beta cells / response to glucose / response to cAMP / cellular response to epinephrine stimulus / response to nutrient / glycolytic process / cellular response to insulin stimulus /  kinase activity / response to hypoxia / kinase activity / response to hypoxia /  リン酸化 / magnesium ion binding / extracellular exosome / リン酸化 / magnesium ion binding / extracellular exosome /  ATP binding / ATP binding /  細胞質基質 / 細胞質基質 /  細胞質類似検索 - 分子機能 細胞質類似検索 - 分子機能 Pyruvate kinase, C-terminal domain / Pyruvate kinase, C-terminal domain /  Pyruvate Kinase; Chain: A, domain 1 / Pyruvate Kinase; Chain: A, domain 1 /  Pyruvate kinase, active site / Pyruvate kinase active site signature. / Pyruvate kinase, active site / Pyruvate kinase active site signature. /  ピルビン酸キナーゼ / ピルビン酸キナーゼ /  Pyruvate kinase, barrel / Pyruvate kinase, barrel /  Pyruvate kinase, insert domain superfamily / Pyruvate kinase, insert domain superfamily /  Pyruvate kinase, barrel domain / Pyruvate kinase, barrel domain /  Pyruvate kinase, C-terminal / Pyruvate kinase, C-terminal /  Pyruvate kinase, C-terminal domain superfamily ... Pyruvate kinase, C-terminal domain superfamily ... Pyruvate kinase, C-terminal domain / Pyruvate kinase, C-terminal domain /  Pyruvate Kinase; Chain: A, domain 1 / Pyruvate Kinase; Chain: A, domain 1 /  Pyruvate kinase, active site / Pyruvate kinase active site signature. / Pyruvate kinase, active site / Pyruvate kinase active site signature. /  ピルビン酸キナーゼ / ピルビン酸キナーゼ /  Pyruvate kinase, barrel / Pyruvate kinase, barrel /  Pyruvate kinase, insert domain superfamily / Pyruvate kinase, insert domain superfamily /  Pyruvate kinase, barrel domain / Pyruvate kinase, barrel domain /  Pyruvate kinase, C-terminal / Pyruvate kinase, C-terminal /  Pyruvate kinase, C-terminal domain superfamily / Pyruvate kinase, C-terminal domain superfamily /  Pyruvate kinase, alpha/beta domain / Pyruvate kinase-like, insert domain superfamily / Phosphoenolpyruvate-binding domains / Pyruvate kinase-like domain superfamily / Pyruvate/Phosphoenolpyruvate kinase-like domain superfamily / Pyruvate kinase, alpha/beta domain / Pyruvate kinase-like, insert domain superfamily / Phosphoenolpyruvate-binding domains / Pyruvate kinase-like domain superfamily / Pyruvate/Phosphoenolpyruvate kinase-like domain superfamily /  TIMバレル / Alpha-Beta Barrel / 3-Layer(aba) Sandwich / Alpha Beta類似検索 - ドメイン・相同性 TIMバレル / Alpha-Beta Barrel / 3-Layer(aba) Sandwich / Alpha Beta類似検索 - ドメイン・相同性1,6-di-O-phosphono-beta-D-fructofuranose / PHOSPHOENOLPYRUVATE /  Pyruvate kinase PKLR類似検索 - 構成要素 Pyruvate kinase PKLR類似検索 - 構成要素 |
|---|
| 生物種 |   Homo sapiens (ヒト) Homo sapiens (ヒト) |
|---|
| 手法 |  X線回折 / X線回折 /  シンクロトロン / シンクロトロン /  分子置換 / 解像度: 2.15 Å 分子置換 / 解像度: 2.15 Å |
|---|
 データ登録者 データ登録者 | McFarlane, J.S. / Ronnebaum, T.A. / Meneely, K.M. / Fenton, A.W. / Lamb, A.L. |
|---|
| 資金援助 |  米国, 5件 米国, 5件 | 組織 | 認可番号 | 国 |
|---|
| National Institutes of Health/National Human Genome Research Institute (NIH/NHGRI) | R01GM115340 |  米国 米国 | | National Institutes of Health/National Human Genome Research Institute (NIH/NHGRI) | R01GM127655 |  米国 米国 | | National Science Foundation (NSF, United States) | CHE1403293 |  米国 米国 | | National Institutes of Health/National Human Genome Research Institute (NIH/NHGRI) | T32GM08545 |  米国 米国 | | American Heart Association | PRE33960374 |  米国 米国 |
|
|---|
 引用 引用 |  ジャーナル: Acta Crystallogr.,Sect.F / 年: 2019 ジャーナル: Acta Crystallogr.,Sect.F / 年: 2019
タイトル: Changes in the allosteric site of human liver pyruvate kinase upon activator binding include the breakage of an intersubunit cation-pi bond.
著者: McFarlane, J.S. / Ronnebaum, T.A. / Meneely, K.M. / Chilton, A. / Fenton, A.W. / Lamb, A.L. |
|---|
| 履歴 | | 登録 | 2019年1月14日 | 登録サイト: RCSB / 処理サイト: RCSB |
|---|
| 改定 1.0 | 2019年6月19日 | Provider: repository / タイプ: Initial release |
|---|
| 改定 1.1 | 2019年11月13日 | Group: Database references / カテゴリ: citation / citation_author
Item: _citation.pdbx_database_id_DOI / _citation.pdbx_database_id_PubMed ..._citation.pdbx_database_id_DOI / _citation.pdbx_database_id_PubMed / _citation.title / _citation_author.identifier_ORCID |
|---|
| 改定 1.2 | 2019年11月27日 | Group: Author supporting evidence / カテゴリ: pdbx_audit_support / Item: _pdbx_audit_support.funding_organization |
|---|
| 改定 1.3 | 2020年7月29日 | Group: Data collection / Derived calculations / Structure summary
カテゴリ: chem_comp / entity ...chem_comp / entity / pdbx_chem_comp_identifier / pdbx_entity_nonpoly / struct_site / struct_site_gen
Item: _chem_comp.mon_nstd_flag / _chem_comp.name ..._chem_comp.mon_nstd_flag / _chem_comp.name / _chem_comp.type / _entity.pdbx_description / _pdbx_entity_nonpoly.name
解説: Carbohydrate remediation / Provider: repository / タイプ: Remediation |
|---|
| 改定 1.4 | 2023年10月11日 | Group: Data collection / Database references ...Data collection / Database references / Refinement description / Structure summary
カテゴリ: chem_comp / chem_comp_atom ...chem_comp / chem_comp_atom / chem_comp_bond / database_2 / pdbx_initial_refinement_model
Item: _chem_comp.pdbx_synonyms / _database_2.pdbx_DOI / _database_2.pdbx_database_accession |
|---|
|
|---|
 データを開く
データを開く 基本情報
基本情報 要素
要素
 キーワード
キーワード TRANSFERASE (転移酵素) /
TRANSFERASE (転移酵素) /  pyruvate kinase (ピルビン酸キナーゼ) /
pyruvate kinase (ピルビン酸キナーゼ) /  allosteric (アロステリック効果) /
allosteric (アロステリック効果) /  glycolysis (解糖系)
glycolysis (解糖系) 機能・相同性情報
機能・相同性情報 pyruvate kinase complex / pyruvate biosynthetic process / SARS-CoV-1-host interactions / ChREBP activates metabolic gene expression /
pyruvate kinase complex / pyruvate biosynthetic process / SARS-CoV-1-host interactions / ChREBP activates metabolic gene expression /  ピルビン酸キナーゼ /
ピルビン酸キナーゼ /  pyruvate kinase activity / response to metal ion /
pyruvate kinase activity / response to metal ion /  monosaccharide binding /
monosaccharide binding /  解糖系 / response to ATP ...
解糖系 / response to ATP ... pyruvate kinase complex / pyruvate biosynthetic process / SARS-CoV-1-host interactions / ChREBP activates metabolic gene expression /
pyruvate kinase complex / pyruvate biosynthetic process / SARS-CoV-1-host interactions / ChREBP activates metabolic gene expression /  ピルビン酸キナーゼ /
ピルビン酸キナーゼ /  pyruvate kinase activity / response to metal ion /
pyruvate kinase activity / response to metal ion /  monosaccharide binding /
monosaccharide binding /  解糖系 / response to ATP /
解糖系 / response to ATP /  potassium ion binding /
potassium ion binding /  Regulation of gene expression in beta cells / response to glucose / response to cAMP / cellular response to epinephrine stimulus / response to nutrient / glycolytic process / cellular response to insulin stimulus /
Regulation of gene expression in beta cells / response to glucose / response to cAMP / cellular response to epinephrine stimulus / response to nutrient / glycolytic process / cellular response to insulin stimulus /  kinase activity / response to hypoxia /
kinase activity / response to hypoxia /  リン酸化 / magnesium ion binding / extracellular exosome /
リン酸化 / magnesium ion binding / extracellular exosome /  ATP binding /
ATP binding /  細胞質基質 /
細胞質基質 /  細胞質
細胞質
 Homo sapiens (ヒト)
Homo sapiens (ヒト) X線回折 /
X線回折 /  シンクロトロン /
シンクロトロン /  分子置換 / 解像度: 2.15 Å
分子置換 / 解像度: 2.15 Å  データ登録者
データ登録者 米国, 5件
米国, 5件  引用
引用 ジャーナル: Acta Crystallogr.,Sect.F / 年: 2019
ジャーナル: Acta Crystallogr.,Sect.F / 年: 2019 構造の表示
構造の表示 Molmil
Molmil Jmol/JSmol
Jmol/JSmol ダウンロードとリンク
ダウンロードとリンク ダウンロード
ダウンロード 6nn4.cif.gz
6nn4.cif.gz PDBx/mmCIF形式
PDBx/mmCIF形式 pdb6nn4.ent.gz
pdb6nn4.ent.gz PDB形式
PDB形式 6nn4.json.gz
6nn4.json.gz PDBx/mmJSON形式
PDBx/mmJSON形式 その他のダウンロード
その他のダウンロード https://data.pdbj.org/pub/pdb/validation_reports/nn/6nn4
https://data.pdbj.org/pub/pdb/validation_reports/nn/6nn4 ftp://data.pdbj.org/pub/pdb/validation_reports/nn/6nn4
ftp://data.pdbj.org/pub/pdb/validation_reports/nn/6nn4 リンク
リンク 集合体
集合体
 要素
要素 / Pyruvate kinase 1 / Pyruvate kinase isozymes L/R / R-type/L-type pyruvate kinase / Red cell/liver ...Pyruvate kinase 1 / Pyruvate kinase isozymes L/R / R-type/L-type pyruvate kinase / Red cell/liver pyruvate kinase
/ Pyruvate kinase 1 / Pyruvate kinase isozymes L/R / R-type/L-type pyruvate kinase / Red cell/liver ...Pyruvate kinase 1 / Pyruvate kinase isozymes L/R / R-type/L-type pyruvate kinase / Red cell/liver pyruvate kinase
 Homo sapiens (ヒト) / 遺伝子: PKLR, PK1, PKL / 発現宿主:
Homo sapiens (ヒト) / 遺伝子: PKLR, PK1, PKL / 発現宿主: 
 Escherichia coli (大腸菌) / 参照: UniProt: P30613,
Escherichia coli (大腸菌) / 参照: UniProt: P30613,  ピルビン酸キナーゼ
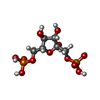
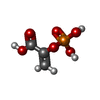
ピルビン酸キナーゼ フルクトース-1,6-ビスリン酸
フルクトース-1,6-ビスリン酸 エチレングリコール
エチレングリコール ホスホエノールピルビン酸
ホスホエノールピルビン酸 水
水 X線回折 / 使用した結晶の数: 1
X線回折 / 使用した結晶の数: 1  試料調製
試料調製
 シンクロトロン / サイト:
シンクロトロン / サイト:  SSRL
SSRL  / ビームライン: BL12-2 / 波長: 0.97946 Å
/ ビームライン: BL12-2 / 波長: 0.97946 Å : 0.97946 Å / 相対比: 1
: 0.97946 Å / 相対比: 1  解析
解析 :
:  分子置換
分子置換 ムービー
ムービー コントローラー
コントローラー















 PDBj
PDBj