登録情報 データベース : PDB / ID : 4ca5タイトル Human Angiotensin converting enzyme in complex with a phosphinic tripeptide FI ANGIOTENSIN-CONVERTING ENZYME キーワード / / 機能・相同性 生物種 HOMO SAPIENS (ヒト)手法 / / / 解像度 : 1.85 Å データ登録者 Masuyer, G. / Akif, M. / Czarny, B. / Beau, F. / Schwager, S.L.U. / Sturrock, E.D. / Isaac, R.E. / Dive, V. / Acharya, K.R. ジャーナル : FEBS J. / 年 : 2014タイトル : Crystal Structures of Highly Specific Phosphinic Tripeptide Enantiomers in Complex with the Angiotensin-I Converting Enzyme.著者 : Masuyer, G. / Akif, M. / Czarny, B. / Beau, F. / Schwager, S.L. / Sturrock, E.D. / Isaac, R.E. / Dive, V. / Acharya, K.R. 履歴 登録 2013年10月7日 登録サイト / 処理サイト 改定 1.0 2013年12月11日 Provider / タイプ 改定 1.1 2014年2月12日 Group 改定 2.0 2020年7月29日 Group Atomic model / Data collection ... Atomic model / Data collection / Derived calculations / Other / Structure summary カテゴリ atom_site / atom_site_anisotrop ... atom_site / atom_site_anisotrop / chem_comp / entity / pdbx_branch_scheme / pdbx_chem_comp_identifier / pdbx_database_status / pdbx_entity_branch / pdbx_entity_branch_descriptor / pdbx_entity_branch_link / pdbx_entity_branch_list / pdbx_entity_nonpoly / pdbx_nonpoly_scheme / pdbx_struct_assembly_gen / pdbx_struct_conn_angle / struct_asym / struct_conn / struct_site / struct_site_gen Item _atom_site.B_iso_or_equiv / _atom_site.Cartn_x ... _atom_site.B_iso_or_equiv / _atom_site.Cartn_x / _atom_site.Cartn_y / _atom_site.Cartn_z / _atom_site.auth_asym_id / _atom_site.auth_atom_id / _atom_site.auth_comp_id / _atom_site.auth_seq_id / _atom_site.label_asym_id / _atom_site.label_atom_id / _atom_site.label_comp_id / _atom_site.label_entity_id / _atom_site.type_symbol / _atom_site_anisotrop.U[1][1] / _atom_site_anisotrop.U[1][2] / _atom_site_anisotrop.U[1][3] / _atom_site_anisotrop.U[2][2] / _atom_site_anisotrop.U[2][3] / _atom_site_anisotrop.U[3][3] / _atom_site_anisotrop.id / _atom_site_anisotrop.pdbx_auth_asym_id / _atom_site_anisotrop.pdbx_auth_atom_id / _atom_site_anisotrop.pdbx_auth_comp_id / _atom_site_anisotrop.pdbx_auth_seq_id / _atom_site_anisotrop.pdbx_label_asym_id / _atom_site_anisotrop.pdbx_label_atom_id / _atom_site_anisotrop.pdbx_label_comp_id / _atom_site_anisotrop.type_symbol / _chem_comp.name / _chem_comp.type / _entity.formula_weight / _entity.pdbx_description / _entity.pdbx_number_of_molecules / _entity.src_method / _entity.type / _pdbx_database_status.status_code_sf / _pdbx_struct_assembly_gen.asym_id_list / _pdbx_struct_conn_angle.ptnr1_auth_comp_id / _pdbx_struct_conn_angle.ptnr1_auth_seq_id / _pdbx_struct_conn_angle.ptnr1_label_asym_id / _pdbx_struct_conn_angle.ptnr1_label_atom_id / _pdbx_struct_conn_angle.ptnr1_label_comp_id / _pdbx_struct_conn_angle.ptnr1_label_seq_id / _pdbx_struct_conn_angle.ptnr2_label_asym_id / _pdbx_struct_conn_angle.ptnr3_auth_comp_id / _pdbx_struct_conn_angle.ptnr3_auth_seq_id / _pdbx_struct_conn_angle.ptnr3_label_asym_id / _pdbx_struct_conn_angle.ptnr3_label_atom_id / _pdbx_struct_conn_angle.ptnr3_label_comp_id / _pdbx_struct_conn_angle.ptnr3_label_seq_id / _pdbx_struct_conn_angle.value / _struct_conn.conn_type_id / _struct_conn.id / _struct_conn.pdbx_dist_value / _struct_conn.pdbx_leaving_atom_flag / _struct_conn.pdbx_role / _struct_conn.ptnr1_auth_asym_id / _struct_conn.ptnr1_auth_comp_id / _struct_conn.ptnr1_auth_seq_id / _struct_conn.ptnr1_label_asym_id / _struct_conn.ptnr1_label_atom_id / _struct_conn.ptnr1_label_comp_id / _struct_conn.ptnr1_label_seq_id / _struct_conn.ptnr2_auth_asym_id / _struct_conn.ptnr2_auth_comp_id / _struct_conn.ptnr2_auth_seq_id / _struct_conn.ptnr2_label_asym_id / _struct_conn.ptnr2_label_atom_id / _struct_conn.ptnr2_label_comp_id / _struct_conn.ptnr2_label_seq_id 解説 / Provider / タイプ 改定 2.1 2023年12月20日 Group Data collection / Database references ... Data collection / Database references / Refinement description / Structure summary カテゴリ chem_comp / chem_comp_atom ... chem_comp / chem_comp_atom / chem_comp_bond / database_2 / pdbx_initial_refinement_model Item / _database_2.pdbx_DOI / _database_2.pdbx_database_accession
すべて表示 表示を減らす
 データを開く
データを開く 基本情報
基本情報 要素
要素 アンジオテンシン変換酵素
アンジオテンシン変換酵素  キーワード
キーワード HYDROLASE (加水分解酵素) / ZINC METALLOPEPTIDASE /
HYDROLASE (加水分解酵素) / ZINC METALLOPEPTIDASE /  INHIBITOR BINDING (酵素阻害剤)
INHIBITOR BINDING (酵素阻害剤) 機能・相同性情報
機能・相同性情報 cell proliferation in bone marrow /
cell proliferation in bone marrow /  bradykinin receptor binding / regulation of angiotensin metabolic process /
bradykinin receptor binding / regulation of angiotensin metabolic process /  exopeptidase activity / tripeptidyl-peptidase activity / substance P catabolic process /
exopeptidase activity / tripeptidyl-peptidase activity / substance P catabolic process /  アンジオテンシン変換酵素 / regulation of renal output by angiotensin / negative regulation of calcium ion import ...mononuclear cell proliferation /
アンジオテンシン変換酵素 / regulation of renal output by angiotensin / negative regulation of calcium ion import ...mononuclear cell proliferation /  cell proliferation in bone marrow /
cell proliferation in bone marrow /  bradykinin receptor binding / regulation of angiotensin metabolic process /
bradykinin receptor binding / regulation of angiotensin metabolic process /  exopeptidase activity / tripeptidyl-peptidase activity / substance P catabolic process /
exopeptidase activity / tripeptidyl-peptidase activity / substance P catabolic process /  アンジオテンシン変換酵素 / regulation of renal output by angiotensin / negative regulation of calcium ion import / positive regulation of peptidyl-cysteine S-nitrosylation / response to laminar fluid shear stress / positive regulation of systemic arterial blood pressure / negative regulation of gap junction assembly / metallodipeptidase activity / cellular response to aldosterone / hormone catabolic process / bradykinin catabolic process / angiogenesis involved in coronary vascular morphogenesis / response to thyroid hormone / negative regulation of glucose import /
アンジオテンシン変換酵素 / regulation of renal output by angiotensin / negative regulation of calcium ion import / positive regulation of peptidyl-cysteine S-nitrosylation / response to laminar fluid shear stress / positive regulation of systemic arterial blood pressure / negative regulation of gap junction assembly / metallodipeptidase activity / cellular response to aldosterone / hormone catabolic process / bradykinin catabolic process / angiogenesis involved in coronary vascular morphogenesis / response to thyroid hormone / negative regulation of glucose import /  血管収縮 / antigen processing and presentation of peptide antigen via MHC class I / neutrophil mediated immunity / hormone metabolic process / regulation of smooth muscle cell migration / regulation of hematopoietic stem cell proliferation / mitogen-activated protein kinase binding / embryo development ending in birth or egg hatching /
血管収縮 / antigen processing and presentation of peptide antigen via MHC class I / neutrophil mediated immunity / hormone metabolic process / regulation of smooth muscle cell migration / regulation of hematopoietic stem cell proliferation / mitogen-activated protein kinase binding / embryo development ending in birth or egg hatching /  chloride ion binding / positive regulation of neurogenesis / mitogen-activated protein kinase kinase binding / arachidonic acid secretion / post-transcriptional regulation of gene expression /
chloride ion binding / positive regulation of neurogenesis / mitogen-activated protein kinase kinase binding / arachidonic acid secretion / post-transcriptional regulation of gene expression /  eating behavior /
eating behavior /  heterocyclic compound binding / peptide catabolic process /
heterocyclic compound binding / peptide catabolic process /  heart contraction / lung alveolus development / response to dexamethasone / regulation of heart rate by cardiac conduction / regulation of systemic arterial blood pressure by renin-angiotensin /
heart contraction / lung alveolus development / response to dexamethasone / regulation of heart rate by cardiac conduction / regulation of systemic arterial blood pressure by renin-angiotensin /  regulation of vasoconstriction / peptidyl-dipeptidase activity / hematopoietic stem cell differentiation / angiotensin maturation / blood vessel remodeling / amyloid-beta metabolic process / animal organ regeneration / Metabolism of Angiotensinogen to Angiotensins /
regulation of vasoconstriction / peptidyl-dipeptidase activity / hematopoietic stem cell differentiation / angiotensin maturation / blood vessel remodeling / amyloid-beta metabolic process / animal organ regeneration / Metabolism of Angiotensinogen to Angiotensins /  carboxypeptidase activity / positive regulation of vasoconstriction / sperm midpiece / blood vessel diameter maintenance / response to nutrient levels / basal plasma membrane /
carboxypeptidase activity / positive regulation of vasoconstriction / sperm midpiece / blood vessel diameter maintenance / response to nutrient levels / basal plasma membrane /  kidney development / female pregnancy / angiotensin-activated signaling pathway / brush border membrane / cellular response to glucose stimulus /
kidney development / female pregnancy / angiotensin-activated signaling pathway / brush border membrane / cellular response to glucose stimulus /  regulation of synaptic plasticity /
regulation of synaptic plasticity /  metalloendopeptidase activity /
metalloendopeptidase activity /  血圧 /
血圧 /  metallopeptidase activity / male gonad development /
metallopeptidase activity / male gonad development /  actin binding /
actin binding /  peptidase activity /
peptidase activity /  精子形成 /
精子形成 /  endopeptidase activity / response to lipopolysaccharide /
endopeptidase activity / response to lipopolysaccharide /  リソソーム /
リソソーム /  calmodulin binding / response to hypoxia /
calmodulin binding / response to hypoxia /  エンドソーム / response to xenobiotic stimulus / positive regulation of apoptotic process / external side of plasma membrane / negative regulation of gene expression /
エンドソーム / response to xenobiotic stimulus / positive regulation of apoptotic process / external side of plasma membrane / negative regulation of gene expression /  タンパク質分解 /
タンパク質分解 /  extracellular space / extracellular exosome / zinc ion binding / extracellular region /
extracellular space / extracellular exosome / zinc ion binding / extracellular region /  細胞膜
細胞膜
 HOMO SAPIENS (ヒト)
HOMO SAPIENS (ヒト) X線回折 /
X線回折 /  シンクロトロン /
シンクロトロン /  分子置換 / 解像度: 1.85 Å
分子置換 / 解像度: 1.85 Å  データ登録者
データ登録者 引用
引用 ジャーナル: FEBS J. / 年: 2014
ジャーナル: FEBS J. / 年: 2014 構造の表示
構造の表示 Molmil
Molmil Jmol/JSmol
Jmol/JSmol ダウンロードとリンク
ダウンロードとリンク ダウンロード
ダウンロード 4ca5.cif.gz
4ca5.cif.gz PDBx/mmCIF形式
PDBx/mmCIF形式 pdb4ca5.ent.gz
pdb4ca5.ent.gz PDB形式
PDB形式 4ca5.json.gz
4ca5.json.gz PDBx/mmJSON形式
PDBx/mmJSON形式 その他のダウンロード
その他のダウンロード https://data.pdbj.org/pub/pdb/validation_reports/ca/4ca5
https://data.pdbj.org/pub/pdb/validation_reports/ca/4ca5 ftp://data.pdbj.org/pub/pdb/validation_reports/ca/4ca5
ftp://data.pdbj.org/pub/pdb/validation_reports/ca/4ca5 リンク
リンク 集合体
集合体
 要素
要素 アンジオテンシン変換酵素 / ACE / DIPEPTIDYL CARBOXYPEPTIDASE I / KININASE II / CD143 / ANGIOTENSIN-CONVERTING ENZYME / SOLUBLE FORM
アンジオテンシン変換酵素 / ACE / DIPEPTIDYL CARBOXYPEPTIDASE I / KININASE II / CD143 / ANGIOTENSIN-CONVERTING ENZYME / SOLUBLE FORM
 HOMO SAPIENS (ヒト) / 器官: TESTIS
HOMO SAPIENS (ヒト) / 器官: TESTIS 精巣 / 細胞株 (発現宿主): CHO
精巣 / 細胞株 (発現宿主): CHO
 CRICETULUS GRISEUS (モンゴルキヌゲネズミ)
CRICETULUS GRISEUS (モンゴルキヌゲネズミ) 加水分解酵素; 糖加水分解酵素; 配糖体結合加水分解酵素または糖加水分解酵素,
加水分解酵素; 糖加水分解酵素; 配糖体結合加水分解酵素または糖加水分解酵素,  アンジオテンシン変換酵素
アンジオテンシン変換酵素
 オリゴ糖 / 分子量: 570.542 Da / 分子数: 1 / 由来タイプ: 組換発現
オリゴ糖 / 分子量: 570.542 Da / 分子数: 1 / 由来タイプ: 組換発現 N-アセチルグルコサミン
N-アセチルグルコサミン



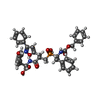






 塩化物
塩化物 酢酸塩
酢酸塩 ジエチレングリコール
ジエチレングリコール 水
水 X線回折 / 使用した結晶の数: 1
X線回折 / 使用した結晶の数: 1  試料調製
試料調製
 シンクロトロン / サイト:
シンクロトロン / サイト:  Diamond
Diamond  / ビームライン: I02 / 波長: 0.9795
/ ビームライン: I02 / 波長: 0.9795  : 0.9795 Å / 相対比: 1
: 0.9795 Å / 相対比: 1  解析
解析 :
:  分子置換
分子置換 ムービー
ムービー コントローラー
コントローラー

















 PDBj
PDBj







