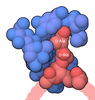
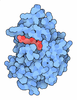
登録情報 データベース : PDB / ID : 3tdcタイトル Crystal Structure of Human Acetyl-CoA carboxylase 2 Acetyl-CoA carboxylase 2 variant キーワード / / / / 機能・相同性 分子機能 ドメイン・相同性 構成要素
/ / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / 生物種 Homo sapiens (ヒト)手法 / / / 解像度 : 2.41 Å データ登録者 Dougan, D.R. / Mol, C.D. ジャーナル : Bioorg.Med.Chem.Lett. / 年 : 2011タイトル : Design, synthesis, and structure-activity relationships of spirolactones bearing 2-ureidobenzothiophene as acetyl-CoA carboxylases inhibitors.著者: Yamashita, T. / Kamata, M. / Endo, S. / Yamamoto, M. / Kakegawa, K. / Watanabe, H. / Miwa, K. / Yamano, T. / Funata, M. / Sakamoto, J. / Tani, A. / Mol, C.D. / Zou, H. / Dougan, D.R. / Sang, ... 著者 : Yamashita, T. / Kamata, M. / Endo, S. / Yamamoto, M. / Kakegawa, K. / Watanabe, H. / Miwa, K. / Yamano, T. / Funata, M. / Sakamoto, J. / Tani, A. / Mol, C.D. / Zou, H. / Dougan, D.R. / Sang, B. / Snell, G. / Fukatsu, K. 履歴 登録 2011年8月10日 登録サイト / 処理サイト 改定 1.0 2011年10月12日 Provider / タイプ 改定 1.1 2011年11月16日 Group 改定 1.2 2023年9月13日 Group Data collection / Database references ... Data collection / Database references / Derived calculations / Refinement description カテゴリ chem_comp_atom / chem_comp_bond ... chem_comp_atom / chem_comp_bond / database_2 / pdbx_initial_refinement_model / struct_ref_seq_dif / struct_site Item _database_2.pdbx_DOI / _database_2.pdbx_database_accession ... _database_2.pdbx_DOI / _database_2.pdbx_database_accession / _struct_ref_seq_dif.details / _struct_site.pdbx_auth_asym_id / _struct_site.pdbx_auth_comp_id / _struct_site.pdbx_auth_seq_id
すべて表示 表示を減らす
 データを開く
データを開く 基本情報
基本情報 要素
要素 キーワード
キーワード biotin (ビオチン) /
biotin (ビオチン) /  malonyl-CoA (マロニルCoA) /
malonyl-CoA (マロニルCoA) /  carboxylase (カルボキシル化) / LIGASE-LIGASE INHIBITOR complex
carboxylase (カルボキシル化) / LIGASE-LIGASE INHIBITOR complex 機能・相同性情報
機能・相同性情報 アセチルCoAカルボキシラーゼ / Biotin transport and metabolism / negative regulation of fatty acid beta-oxidation / acetyl-CoA metabolic process / tricarboxylic acid metabolic process ...intracellular aspartate homeostasis / lactic acid secretion / mitochondrial fatty acid beta-oxidation multienzyme complex / regulation of cardiac muscle hypertrophy in response to stress / positive regulation of heart growth /
アセチルCoAカルボキシラーゼ / Biotin transport and metabolism / negative regulation of fatty acid beta-oxidation / acetyl-CoA metabolic process / tricarboxylic acid metabolic process ...intracellular aspartate homeostasis / lactic acid secretion / mitochondrial fatty acid beta-oxidation multienzyme complex / regulation of cardiac muscle hypertrophy in response to stress / positive regulation of heart growth /  アセチルCoAカルボキシラーゼ / Biotin transport and metabolism / negative regulation of fatty acid beta-oxidation / acetyl-CoA metabolic process / tricarboxylic acid metabolic process / malonyl-CoA biosynthetic process / ChREBP activates metabolic gene expression /
アセチルCoAカルボキシラーゼ / Biotin transport and metabolism / negative regulation of fatty acid beta-oxidation / acetyl-CoA metabolic process / tricarboxylic acid metabolic process / malonyl-CoA biosynthetic process / ChREBP activates metabolic gene expression /  acetyl-CoA carboxylase activity / intracellular glutamate homeostasis / positive regulation of lipid storage / pentose-phosphate shunt / Carnitine metabolism /
acetyl-CoA carboxylase activity / intracellular glutamate homeostasis / positive regulation of lipid storage / pentose-phosphate shunt / Carnitine metabolism /  biotin binding / glucose import /
biotin binding / glucose import /  Β酸化 / regulation of glucose metabolic process /
Β酸化 / regulation of glucose metabolic process /  energy homeostasis / response to nutrient / Activation of gene expression by SREBF (SREBP) / response to organic cyclic compound / fatty acid biosynthetic process / protein homotetramerization / mitochondrial outer membrane / response to xenobiotic stimulus / negative regulation of gene expression /
energy homeostasis / response to nutrient / Activation of gene expression by SREBF (SREBP) / response to organic cyclic compound / fatty acid biosynthetic process / protein homotetramerization / mitochondrial outer membrane / response to xenobiotic stimulus / negative regulation of gene expression /  ミトコンドリア /
ミトコンドリア /  ATP binding / identical protein binding /
ATP binding / identical protein binding /  metal ion binding /
metal ion binding /  細胞核 /
細胞核 /  細胞質基質
細胞質基質
 Homo sapiens (ヒト)
Homo sapiens (ヒト) X線回折 /
X線回折 /  シンクロトロン /
シンクロトロン /  分子置換 / 解像度: 2.41 Å
分子置換 / 解像度: 2.41 Å  データ登録者
データ登録者 引用
引用 ジャーナル: Bioorg.Med.Chem.Lett. / 年: 2011
ジャーナル: Bioorg.Med.Chem.Lett. / 年: 2011 構造の表示
構造の表示 Molmil
Molmil Jmol/JSmol
Jmol/JSmol ダウンロードとリンク
ダウンロードとリンク ダウンロード
ダウンロード 3tdc.cif.gz
3tdc.cif.gz PDBx/mmCIF形式
PDBx/mmCIF形式 pdb3tdc.ent.gz
pdb3tdc.ent.gz PDB形式
PDB形式 3tdc.json.gz
3tdc.json.gz PDBx/mmJSON形式
PDBx/mmJSON形式 その他のダウンロード
その他のダウンロード https://data.pdbj.org/pub/pdb/validation_reports/td/3tdc
https://data.pdbj.org/pub/pdb/validation_reports/td/3tdc ftp://data.pdbj.org/pub/pdb/validation_reports/td/3tdc
ftp://data.pdbj.org/pub/pdb/validation_reports/td/3tdc
 リンク
リンク 集合体
集合体

 要素
要素
 Homo sapiens (ヒト)
Homo sapiens (ヒト)
 Spodoptera frugiperda (ツマジロクサヨトウ)
Spodoptera frugiperda (ツマジロクサヨトウ) アセチルCoAカルボキシラーゼ
アセチルCoAカルボキシラーゼ 水
水 X線回折 / 使用した結晶の数: 1
X線回折 / 使用した結晶の数: 1  試料調製
試料調製
 シンクロトロン / サイト:
シンクロトロン / サイト:  ALS
ALS  / ビームライン: 5.0.1 / 波長: 0.9764 Å
/ ビームライン: 5.0.1 / 波長: 0.9764 Å : 0.9764 Å / 相対比: 1
: 0.9764 Å / 相対比: 1  解析
解析 :
:  分子置換
分子置換 ムービー
ムービー コントローラー
コントローラー











 PDBj
PDBj