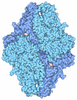
登録情報 データベース : PDB / ID : 3dx1タイトル Golgi alpha-Mannosidase II in complex with Mannostatin analog (1S,2S,3R,4R)-4-aminocyclopentane-1,2,3-triol Alpha-mannosidase 2 キーワード / / / / / / / 機能・相同性 分子機能 ドメイン・相同性 構成要素
/ / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / 生物種 Drosophila melanogaster (キイロショウジョウバエ)手法 / / / 解像度 : 1.21 Å データ登録者 Kuntz, D.A. / Rose, D.R. ジャーナル : Chembiochem / 年 : 2009タイトル : The molecular basis of inhibition of Golgi alpha-mannosidase II by mannostatin A.著者 : Kuntz, D.A. / Zhong, W. / Guo, J. / Rose, D.R. / Boons, G.J. 履歴 登録 2008年7月23日 登録サイト / 処理サイト 改定 1.0 2009年7月7日 Provider / タイプ 改定 1.1 2011年7月13日 Group / Version format compliance改定 1.2 2017年10月25日 Group / カテゴリ Item _software.classification / _software.contact_author ... _software.classification / _software.contact_author / _software.contact_author_email / _software.date / _software.language / _software.location / _software.name / _software.type / _software.version 改定 1.3 2019年7月24日 Group / Derived calculations / Refinement descriptionカテゴリ / struct_connItem _software.classification / _software.contact_author ... _software.classification / _software.contact_author / _software.contact_author_email / _software.location / _software.name / _software.type / _struct_conn.pdbx_leaving_atom_flag 改定 1.4 2020年7月29日 Group Advisory / Data collection ... Advisory / Data collection / Database references / Derived calculations / Structure summary カテゴリ chem_comp / database_PDB_caveat ... chem_comp / database_PDB_caveat / entity / pdbx_chem_comp_identifier / pdbx_distant_solvent_atoms / pdbx_entity_nonpoly / struct_conn / struct_conn_type / struct_ref_seq_dif / struct_site / struct_site_gen Item _chem_comp.name / _chem_comp.type ... _chem_comp.name / _chem_comp.type / _entity.pdbx_description / _pdbx_entity_nonpoly.name / _struct_conn.conn_type_id / _struct_conn.id / _struct_conn.pdbx_dist_value / _struct_conn.pdbx_leaving_atom_flag / _struct_conn.pdbx_role / _struct_conn.ptnr1_auth_comp_id / _struct_conn.ptnr1_auth_seq_id / _struct_conn.ptnr1_label_atom_id / _struct_conn.ptnr1_label_comp_id / _struct_conn.ptnr1_label_seq_id / _struct_conn.ptnr2_auth_comp_id / _struct_conn.ptnr2_auth_seq_id / _struct_conn.ptnr2_label_asym_id / _struct_conn.ptnr2_label_atom_id / _struct_conn.ptnr2_label_comp_id / _struct_conn_type.id / _struct_ref_seq_dif.details 解説 / Provider / タイプ 改定 1.5 2023年8月30日 Group Data collection / Database references ... Data collection / Database references / Refinement description / Structure summary カテゴリ chem_comp / chem_comp_atom ... chem_comp / chem_comp_atom / chem_comp_bond / database_2 / pdbx_initial_refinement_model Item / _database_2.pdbx_DOI / _database_2.pdbx_database_accession
すべて表示 表示を減らす
 データを開く
データを開く 基本情報
基本情報 要素
要素
 キーワード
キーワード HYDROLASE (加水分解酵素) / GH38 Glycosidase / Glycosidase /
HYDROLASE (加水分解酵素) / GH38 Glycosidase / Glycosidase /  Golgi apparatus (ゴルジ体) /
Golgi apparatus (ゴルジ体) /  Membrane (生体膜) / Metal-binding / Signal-anchor /
Membrane (生体膜) / Metal-binding / Signal-anchor /  Transmembrane (膜貫通型タンパク質)
Transmembrane (膜貫通型タンパク質) 機能・相同性情報
機能・相同性情報 mannosyl-oligosaccharide 1,3-1,6-alpha-mannosidase /
mannosyl-oligosaccharide 1,3-1,6-alpha-mannosidase /  mannosyl-oligosaccharide 1,3-1,6-alpha-mannosidase activity / rhodopsin biosynthetic process / encapsulation of foreign target / Reactions specific to the complex N-glycan synthesis pathway /
mannosyl-oligosaccharide 1,3-1,6-alpha-mannosidase activity / rhodopsin biosynthetic process / encapsulation of foreign target / Reactions specific to the complex N-glycan synthesis pathway /  mannosidase activity /
mannosidase activity /  alpha-mannosidase activity / N-glycan processing / mannose metabolic process /
alpha-mannosidase activity / N-glycan processing / mannose metabolic process /  ゴルジ体 ...
ゴルジ体 ... mannosyl-oligosaccharide 1,3-1,6-alpha-mannosidase /
mannosyl-oligosaccharide 1,3-1,6-alpha-mannosidase /  mannosyl-oligosaccharide 1,3-1,6-alpha-mannosidase activity / rhodopsin biosynthetic process / encapsulation of foreign target / Reactions specific to the complex N-glycan synthesis pathway /
mannosyl-oligosaccharide 1,3-1,6-alpha-mannosidase activity / rhodopsin biosynthetic process / encapsulation of foreign target / Reactions specific to the complex N-glycan synthesis pathway /  mannosidase activity /
mannosidase activity /  alpha-mannosidase activity / N-glycan processing / mannose metabolic process /
alpha-mannosidase activity / N-glycan processing / mannose metabolic process /  ゴルジ体 / protein deglycosylation / protein glycosylation /
ゴルジ体 / protein deglycosylation / protein glycosylation /  carbohydrate binding /
carbohydrate binding /  リソソーム /
リソソーム /  ゴルジ体 /
ゴルジ体 /  小胞体 /
小胞体 /  metal ion binding
metal ion binding
 Drosophila melanogaster (キイロショウジョウバエ)
Drosophila melanogaster (キイロショウジョウバエ) X線回折 /
X線回折 /  シンクロトロン /
シンクロトロン /  分子置換 / 解像度: 1.21 Å
分子置換 / 解像度: 1.21 Å  データ登録者
データ登録者 引用
引用 ジャーナル: Chembiochem / 年: 2009
ジャーナル: Chembiochem / 年: 2009 構造の表示
構造の表示 Molmil
Molmil Jmol/JSmol
Jmol/JSmol ダウンロードとリンク
ダウンロードとリンク ダウンロード
ダウンロード 3dx1.cif.gz
3dx1.cif.gz PDBx/mmCIF形式
PDBx/mmCIF形式 pdb3dx1.ent.gz
pdb3dx1.ent.gz PDB形式
PDB形式 3dx1.json.gz
3dx1.json.gz PDBx/mmJSON形式
PDBx/mmJSON形式 その他のダウンロード
その他のダウンロード https://data.pdbj.org/pub/pdb/validation_reports/dx/3dx1
https://data.pdbj.org/pub/pdb/validation_reports/dx/3dx1 ftp://data.pdbj.org/pub/pdb/validation_reports/dx/3dx1
ftp://data.pdbj.org/pub/pdb/validation_reports/dx/3dx1 リンク
リンク 集合体
集合体
 要素
要素

 / Alpha-mannosidase II / AMAN II / MAN II / Mannosyl-oligosaccharide 1 / 3-1 / 6-alpha-mannosidase / ...Alpha-mannosidase II / AMAN II / MAN II / Mannosyl-oligosaccharide 1 / 3-1 / 6-alpha-mannosidase / Golgi alpha-mannosidase II
/ Alpha-mannosidase II / AMAN II / MAN II / Mannosyl-oligosaccharide 1 / 3-1 / 6-alpha-mannosidase / ...Alpha-mannosidase II / AMAN II / MAN II / Mannosyl-oligosaccharide 1 / 3-1 / 6-alpha-mannosidase / Golgi alpha-mannosidase II
 Drosophila melanogaster (キイロショウジョウバエ)
Drosophila melanogaster (キイロショウジョウバエ)
 Drosophila melanogaster (キイロショウジョウバエ)
Drosophila melanogaster (キイロショウジョウバエ) mannosyl-oligosaccharide 1,3-1,6-alpha-mannosidase
mannosyl-oligosaccharide 1,3-1,6-alpha-mannosidase N-アセチルグルコサミン
N-アセチルグルコサミン

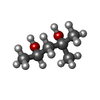






 リン酸塩
リン酸塩 2-Methyl-2,4-pentanediol
2-Methyl-2,4-pentanediol 水
水 X線回折 / 使用した結晶の数: 1
X線回折 / 使用した結晶の数: 1  試料調製
試料調製
 シンクロトロン / サイト:
シンクロトロン / サイト:  CHESS
CHESS  / ビームライン: A1 / 波長: 0.977 Å
/ ビームライン: A1 / 波長: 0.977 Å : 0.977 Å / 相対比: 1
: 0.977 Å / 相対比: 1 
 分子置換
分子置換 解析
解析 :
:  分子置換
分子置換 ムービー
ムービー コントローラー
コントローラー


































 PDBj
PDBj