+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 2mit | ||||||
|---|---|---|---|---|---|---|---|
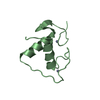
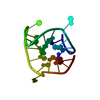
| タイトル | Solution structure of oxidized dimeric form of human defensin 5 | ||||||
 要素 要素 | Defensin-5 ディフェンシン ディフェンシン | ||||||
 キーワード キーワード |  ANTIMICROBIAL PROTEIN (抗微生物ペプチド) / ANTIMICROBIAL PROTEIN (抗微生物ペプチド) /  cysteine knot (シスチンノット) / cysteine knot (シスチンノット) /  antimicrobial peptide (抗微生物ペプチド) antimicrobial peptide (抗微生物ペプチド) | ||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報positive regulation of membrane permeability /  ディフェンシン / disruption of plasma membrane integrity in another organism / killing by host of symbiont cells / Alpha-defensins / defense response to fungus / ディフェンシン / disruption of plasma membrane integrity in another organism / killing by host of symbiont cells / Alpha-defensins / defense response to fungus /  小胞 / 小胞 /  細胞外マトリックス / 細胞外マトリックス /  innate immune response in mucosa / innate immune response in mucosa /  分泌 ...positive regulation of membrane permeability / 分泌 ...positive regulation of membrane permeability /  ディフェンシン / disruption of plasma membrane integrity in another organism / killing by host of symbiont cells / Alpha-defensins / defense response to fungus / ディフェンシン / disruption of plasma membrane integrity in another organism / killing by host of symbiont cells / Alpha-defensins / defense response to fungus /  小胞 / 小胞 /  細胞外マトリックス / 細胞外マトリックス /  innate immune response in mucosa / innate immune response in mucosa /  分泌 / positive regulation of interleukin-8 production / Golgi lumen / antimicrobial humoral immune response mediated by antimicrobial peptide / midbody / antibacterial humoral response / protein homotetramerization / secretory granule lumen / killing of cells of another organism / cellular response to lipopolysaccharide / defense response to Gram-negative bacterium / defense response to Gram-positive bacterium / intracellular membrane-bounded organelle / 分泌 / positive regulation of interleukin-8 production / Golgi lumen / antimicrobial humoral immune response mediated by antimicrobial peptide / midbody / antibacterial humoral response / protein homotetramerization / secretory granule lumen / killing of cells of another organism / cellular response to lipopolysaccharide / defense response to Gram-negative bacterium / defense response to Gram-positive bacterium / intracellular membrane-bounded organelle /  自然免疫系 / protein homodimerization activity / 自然免疫系 / protein homodimerization activity /  extracellular space / extracellular region extracellular space / extracellular region類似検索 - 分子機能 | ||||||
| 生物種 |   Homo sapiens (ヒト) Homo sapiens (ヒト) | ||||||
| 手法 |  溶液NMR / 溶液NMR /  simulated annealing, simulated annealing,  molecular dynamics molecular dynamics | ||||||
| Model details | closest to the average, model1 | ||||||
 データ登録者 データ登録者 | Wommack, A.J. / Ziarek, J.J. / Wagner, G. / Nolan, E.M. | ||||||
 引用 引用 |  ジャーナル: To be Published ジャーナル: To be Publishedタイトル: Solution structure of oxidized dimeric form of human defensin 5 著者: Wommack, A.J. / Ziarek, J.J. / Wagner, G. / Nolan, E.M. | ||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  2mit.cif.gz 2mit.cif.gz | 428.2 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb2mit.ent.gz pdb2mit.ent.gz | 374.3 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  2mit.json.gz 2mit.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/mi/2mit https://data.pdbj.org/pub/pdb/validation_reports/mi/2mit ftp://data.pdbj.org/pub/pdb/validation_reports/mi/2mit ftp://data.pdbj.org/pub/pdb/validation_reports/mi/2mit | HTTPS FTP |
|---|
-関連構造データ
| 関連構造データ | |
|---|---|
| 類似構造データ | |
| その他のデータベース |
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
| |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| 1 |
| |||||||||
| NMR アンサンブル |
|
- 要素
要素
| #1: タンパク質・ペプチド |  ディフェンシン / Defensin / alpha 5 / HD5(63-94) ディフェンシン / Defensin / alpha 5 / HD5(63-94)分子量: 3594.228 Da / 分子数: 2 / 断片: residues 63-94 / 由来タイプ: 組換発現 / 由来: (組換発現)   Homo sapiens (ヒト) / 遺伝子: DEF5, DEFA5 / 発現宿主: Homo sapiens (ヒト) / 遺伝子: DEF5, DEFA5 / 発現宿主:   Escherichia coli (大腸菌) / 参照: UniProt: Q01523 Escherichia coli (大腸菌) / 参照: UniProt: Q01523 |
|---|
-実験情報
-実験
| 実験 | 手法:  溶液NMR 溶液NMR | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| NMR実験 |
|
- 試料調製
試料調製
| 詳細 |
| ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 試料 |
| ||||||||||||||||
| 試料状態 | イオン強度: 0 / pH: 4 / 圧: ambient / 温度: 298 K |
-NMR測定
| NMRスペクトロメーター |
|
|---|
- 解析
解析
| NMR software |
| |||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 精密化 | 手法:  simulated annealing, simulated annealing,  molecular dynamics / ソフトェア番号: 1 molecular dynamics / ソフトェア番号: 1 詳細: Initial structures calculated by minimizing target function. Final CYANA structure refined in explicit water using molecular dynamics. | |||||||||||||||||||||||||||||||||
| NMR constraints | NOE constraints total: 1113 / NOE intraresidue total count: 270 / NOE long range total count: 384 / NOE medium range total count: 118 / NOE sequential total count: 232 / Disulfide bond constraints total count: 18 / Protein chi angle constraints total count: 28 / Protein other angle constraints total count: 0 / Protein phi angle constraints total count: 40 / Protein psi angle constraints total count: 38 | |||||||||||||||||||||||||||||||||
| 代表構造 | 選択基準: closest to the average | |||||||||||||||||||||||||||||||||
| NMRアンサンブル | コンフォーマー選択の基準: structures with the lowest energy 計算したコンフォーマーの数: 100 / 登録したコンフォーマーの数: 20 / Maximum torsion angle constraint violation: 3.3 ° / Maximum upper distance constraint violation: 0.66 Å | |||||||||||||||||||||||||||||||||
| NMR ensemble rms | Distance rms dev: 0.0264 Å / Distance rms dev error: 0.0042 Å |
 ムービー
ムービー コントローラー
コントローラー











 PDBj
PDBj


