+ データを開く
データを開く
- 基本情報
基本情報
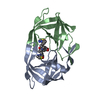
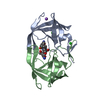
| 登録情報 | データベース: PDB / ID: 1hih | ||||||
|---|---|---|---|---|---|---|---|
| タイトル | COMPARATIVE ANALYSIS OF THE X-RAY STRUCTURES OF HIV-1 AND HIV-2 PROTEASES IN COMPLEX WITH CGP 53820, A NOVEL PSEUDOSYMMETRIC INHIBITOR | ||||||
 要素 要素 | HIV-1 PROTEASE | ||||||
 キーワード キーワード | HYDROLASE (ASPARTIC PROTEINASE) /  ASPARTATE PROTEASE (アスパラギン酸プロテアーゼ) / INHIBITED / ASPARTATE PROTEASE (アスパラギン酸プロテアーゼ) / INHIBITED /  HIV (ヒト免疫不全ウイルス) HIV (ヒト免疫不全ウイルス) | ||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報 HIV-1 retropepsin / HIV-1 retropepsin /  : / : /  retroviral ribonuclease H / retroviral ribonuclease H /  exoribonuclease H / exoribonuclease H /  : / : /  exoribonuclease H activity / host multivesicular body / DNA integration / exoribonuclease H activity / host multivesicular body / DNA integration /  逆転写酵素 / viral genome integration into host DNA ... 逆転写酵素 / viral genome integration into host DNA ... HIV-1 retropepsin / HIV-1 retropepsin /  : / : /  retroviral ribonuclease H / retroviral ribonuclease H /  exoribonuclease H / exoribonuclease H /  : / : /  exoribonuclease H activity / host multivesicular body / DNA integration / exoribonuclease H activity / host multivesicular body / DNA integration /  逆転写酵素 / viral genome integration into host DNA / viral penetration into host nucleus / establishment of integrated proviral latency / 逆転写酵素 / viral genome integration into host DNA / viral penetration into host nucleus / establishment of integrated proviral latency /  RNA-directed DNA polymerase activity / RNA-directed DNA polymerase activity /  転移酵素; リンを含む基を移すもの; 核酸を移すもの / RNA-DNA hybrid ribonuclease activity / viral nucleocapsid / DNA recombination / 転移酵素; リンを含む基を移すもの; 核酸を移すもの / RNA-DNA hybrid ribonuclease activity / viral nucleocapsid / DNA recombination /  加水分解酵素; エステル加水分解酵素 / 加水分解酵素; エステル加水分解酵素 /  DNAポリメラーゼ / aspartic-type endopeptidase activity / DNAポリメラーゼ / aspartic-type endopeptidase activity /  DNA-directed DNA polymerase activity / symbiont entry into host cell / symbiont-mediated suppression of host gene expression / DNA-directed DNA polymerase activity / symbiont entry into host cell / symbiont-mediated suppression of host gene expression /  lipid binding / host cell nucleus / host cell plasma membrane / virion membrane / structural molecule activity / lipid binding / host cell nucleus / host cell plasma membrane / virion membrane / structural molecule activity /  タンパク質分解 / タンパク質分解 /  DNA binding / DNA binding /  RNA binding / zinc ion binding / RNA binding / zinc ion binding /  生体膜 生体膜類似検索 - 分子機能 | ||||||
| 生物種 |    Human immunodeficiency virus 1 (ヒト免疫不全ウイルス) Human immunodeficiency virus 1 (ヒト免疫不全ウイルス) | ||||||
| 手法 |  X線回折 / 解像度: 2.2 Å X線回折 / 解像度: 2.2 Å | ||||||
 データ登録者 データ登録者 | Priestle, J.P. / Gruetter, M.G. | ||||||
 引用 引用 |  ジャーナル: Structure / 年: 1995 ジャーナル: Structure / 年: 1995タイトル: Comparative analysis of the X-ray structures of HIV-1 and HIV-2 proteases in complex with CGP 53820, a novel pseudosymmetric inhibitor. 著者: Priestle, J.P. / Fassler, A. / Rosel, J. / Tintelnot-Blomley, M. / Strop, P. / Grutter, M.G. #1:  ジャーナル: Bioorg.Med.Chem.Lett. / 年: 1993 ジャーナル: Bioorg.Med.Chem.Lett. / 年: 1993タイトル: Novel Pseudosymmetric Inhibitors of HIV-1 Protease 著者: Fassler, A. / Rosel, J. / Tintelnot-Blomley, M. / Alteri, E. / Bold, G. / Lang, M. | ||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  1hih.cif.gz 1hih.cif.gz | 51.1 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb1hih.ent.gz pdb1hih.ent.gz | 39.6 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  1hih.json.gz 1hih.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/hi/1hih https://data.pdbj.org/pub/pdb/validation_reports/hi/1hih ftp://data.pdbj.org/pub/pdb/validation_reports/hi/1hih ftp://data.pdbj.org/pub/pdb/validation_reports/hi/1hih | HTTPS FTP |
|---|
-関連構造データ
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
| ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 1 |
| ||||||||
| 単位格子 |
| ||||||||
| 非結晶学的対称性 (NCS) | NCS oper: (Code: given Matrix: (-0.9989, -0.04432, -0.015), ベクター  : : 詳細 | MTRIX THE TRANSFORMATIONS PRESENTED ON MTRIX RECORDS BELOW DESCRIBE NON-CRYSTALLOGRAPHIC RELATIONSHIPS AMONG THE VARIOUS DOMAINS IN THIS ENTRY. APPLYING THE APPROPRIATE MTRIX TRANSFORMATION TO THE RESIDUES LISTED FIRST WILL YIELD APPROXIMATE COORDINATES FOR THE RESIDUES LISTED SECOND. APPLIED TO TRANSFORMED TO MTRIX RESIDUES RESIDUES RMSD M1 A 1 .. A 99 B 1 .. B 99 0.677 | |
- 要素
要素
| #1: タンパク質 |  分子量: 10803.756 Da / 分子数: 2 / 由来タイプ: 組換発現 由来: (組換発現)    Human immunodeficiency virus 1 (ヒト免疫不全ウイルス) Human immunodeficiency virus 1 (ヒト免疫不全ウイルス)属: Lentivirus  レンチウイルス属 / 細胞株: S2 / 遺伝子: POL / プラスミド: PT7Q10H / 遺伝子 (発現宿主): POL / 発現宿主: レンチウイルス属 / 細胞株: S2 / 遺伝子: POL / プラスミド: PT7Q10H / 遺伝子 (発現宿主): POL / 発現宿主:   Escherichia coli (大腸菌) Escherichia coli (大腸菌)参照: UniProt: P03366,  加水分解酵素; プロテアーゼ; ペプチド結合加水分解酵素; アスパラギン酸プロテアーゼ 加水分解酵素; プロテアーゼ; ペプチド結合加水分解酵素; アスパラギン酸プロテアーゼ#2: 化合物 |  2-メルカプトエタノール 2-メルカプトエタノール#3: 化合物 | ChemComp-C20 / | #4: 水 | ChemComp-HOH / |  水 水構成要素の詳細 | COMPND MOLECULE: HIV-1 PROTEASE. BRU ISOLATE. | 非ポリマーの詳細 | SOURCE 1 MOLECULE_NAME: CGP 53820. PSEUDOSYMMETRIC TRANSITION-STATE ANALOG. SOURCE 2 MOLECULE_NAME: ...SOURCE 1 MOLECULE_NAME: CGP 53820. PSEUDOSYMM | |
|---|
-実験情報
-実験
| 実験 | 手法:  X線回折 X線回折 |
|---|
- 試料調製
試料調製
| 結晶 | マシュー密度: 2.2 Å3/Da / 溶媒含有率: 44.18 % | ||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 結晶 | *PLUS 溶媒含有率: 45 % | ||||||||||||||||||||||||||||||
結晶化 | *PLUS pH: 5.4 / 手法: 蒸気拡散法, ハンギングドロップ法 | ||||||||||||||||||||||||||||||
| 溶液の組成 | *PLUS
|
-データ収集
| 放射光源 | 波長: 1.5418 |
|---|---|
| 検出器 | タイプ: ENRAF-NONIUS FAST / 検出器: DIFFRACTOMETER / 日付: 1993年8月1日 |
| 放射 | 散乱光タイプ: x-ray |
| 放射波長 | 波長 : 1.5418 Å / 相対比: 1 : 1.5418 Å / 相対比: 1 |
| 反射 | Num. obs: 10082 / % possible obs: 99.4 % / Observed criterion σ(I): 0 / 冗長度: 3.05 % / Rmerge(I) obs: 0.057 |
| 反射 | *PLUS 最高解像度: 2.2 Å / Num. measured all: 30789 / Rmerge(I) obs: 0.057 |
| 反射 シェル | *PLUS 最高解像度: 2.2 Å / 最低解像度: 2.26 Å / Rmerge(I) obs: 0.226 |
- 解析
解析
| ソフトウェア |
| ||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 精密化 | 解像度: 2.2→6 Å / σ(F): 0 /
| ||||||||||||||||||||||||||||||
| 原子変位パラメータ | Biso mean: 23.8 Å2 | ||||||||||||||||||||||||||||||
| 精密化ステップ | サイクル: LAST / 解像度: 2.2→6 Å
| ||||||||||||||||||||||||||||||
| 拘束条件 |
| ||||||||||||||||||||||||||||||
| ソフトウェア | *PLUS 名称: TNT / 分類: refinement | ||||||||||||||||||||||||||||||
| 拘束条件 | *PLUS
|
 ムービー
ムービー コントローラー
コントローラー






















 PDBj
PDBj










