+ データを開く
データを開く
- 基本情報
基本情報
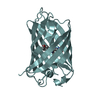
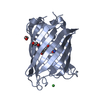
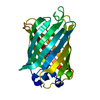
| 登録情報 | データベース: PDB / ID: 1ema | ||||||
|---|---|---|---|---|---|---|---|
| タイトル | GREEN FLUORESCENT PROTEIN FROM AEQUOREA VICTORIA | ||||||
 要素 要素 | GREEN FLUORESCENT PROTEIN 緑色蛍光タンパク質 緑色蛍光タンパク質 | ||||||
 キーワード キーワード |  FLUORESCENT PROTEIN (蛍光タンパク質) / FLUORESCENT PROTEIN (蛍光タンパク質) /  BETA-BARREL (Βバレル) / AUTOCATALYTIC / BETA-BARREL (Βバレル) / AUTOCATALYTIC /  FLUOROPHORE (蛍光色素) / BIOLUMINESCENSE FLUORESCENT PROTEIN FLUOROPHORE (蛍光色素) / BIOLUMINESCENSE FLUORESCENT PROTEIN | ||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報 | ||||||
| 生物種 |   Aequorea victoria (オワンクラゲ) Aequorea victoria (オワンクラゲ) | ||||||
| 手法 |  X線回折 / X線回折 /  シンクロトロン / MIR/SAD / 解像度: 1.9 Å シンクロトロン / MIR/SAD / 解像度: 1.9 Å | ||||||
 データ登録者 データ登録者 | Ormo, M. / Remington, S.J. | ||||||
 引用 引用 |  ジャーナル: Science / 年: 1996 ジャーナル: Science / 年: 1996タイトル: Crystal structure of the Aequorea victoria green fluorescent protein. 著者: Ormo, M. / Cubitt, A.B. / Kallio, K. / Gross, L.A. / Tsien, R.Y. / Remington, S.J. #1:  ジャーナル: Nature / 年: 1995 ジャーナル: Nature / 年: 1995タイトル: Improved Green Fluorescence 著者: Heim, R. / Cubitt, A.B. / Tsien, R.Y. | ||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  1ema.cif.gz 1ema.cif.gz | 59.7 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb1ema.ent.gz pdb1ema.ent.gz | 43.1 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  1ema.json.gz 1ema.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/em/1ema https://data.pdbj.org/pub/pdb/validation_reports/em/1ema ftp://data.pdbj.org/pub/pdb/validation_reports/em/1ema ftp://data.pdbj.org/pub/pdb/validation_reports/em/1ema | HTTPS FTP |
|---|
-関連構造データ
| 類似構造データ |
|---|
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
| ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 1 |
| ||||||||
| 単位格子 |
|
- 要素
要素
| #1: タンパク質 |  緑色蛍光タンパク質 緑色蛍光タンパク質分子量: 27226.754 Da / 分子数: 1 / 変異: 65 - 67 REPLACED BY CRO, Q80R / 由来タイプ: 組換発現 詳細: THE PROTEIN CONTAINS SIX SE-METHIONINES. OF THESE, THE N-TERMINAL MET AND MET 233 ARE NOT PRESENT IN THE ENTRY 由来: (組換発現)   Aequorea victoria (オワンクラゲ) Aequorea victoria (オワンクラゲ)解説: THE N-TERMINAL HIS-TAG HAS BEEN REMOVED / 器官: LEAVES / プラスミド: PRSETB (INVITROGEN) / 発現宿主:   Escherichia coli (大腸菌) / 株 (発現宿主): JM109 (DE3) / 参照: UniProt: P42212 Escherichia coli (大腸菌) / 株 (発現宿主): JM109 (DE3) / 参照: UniProt: P42212 |
|---|---|
| #2: 水 | ChemComp-HOH /  水 水 |
| 配列の詳細 | THE FLUOROPHORE (CRO) IS GENERATED BY AN AUTOCATALYTIC CYCLIZATION OF THE POLYPEPTIDE BACKBONE ...THE FLUOROPHOR |
-実験情報
-実験
| 実験 | 手法:  X線回折 / 使用した結晶の数: 1 X線回折 / 使用した結晶の数: 1 |
|---|
- 試料調製
試料調製
| 結晶 | マシュー密度: 2.1 Å3/Da / 溶媒含有率: 40.5 % | ||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
結晶化 | pH: 8.2 詳細: 22-26% PEG 4000, 50 MM HEPES PH 8.0-8.4, 50 MM MGCL2, 10 MM 2-MERCAPTOETHANOL, 5-7 MG PROTEIN, pH 8.2 PH範囲: 8.0-8.4 | ||||||||||||||||||||||||||||||
| 結晶化 | *PLUS 手法: 蒸気拡散法, ハンギングドロップ法 | ||||||||||||||||||||||||||||||
| 溶液の組成 | *PLUS
|
-データ収集
| 回折 | 平均測定温度: 295 K |
|---|---|
| 放射光源 | 由来:  シンクロトロン / サイト: シンクロトロン / サイト:  NSLS NSLS  / ビームライン: X4A / 波長: 0.979 / ビームライン: X4A / 波長: 0.979 |
| 検出器 | タイプ: FUJI / 検出器: IMAGE PLATE / 日付: 1996年4月28日 |
| 放射 | 単色(M)・ラウエ(L): M / 散乱光タイプ: x-ray |
| 放射波長 | 波長 : 0.979 Å / 相対比: 1 : 0.979 Å / 相対比: 1 |
| 反射 | 最高解像度: 1.9 Å / Num. obs: 17676 / % possible obs: 84 % / Observed criterion σ(I): 0 / 冗長度: 6.45 % / Biso Wilson estimate: 16.5 Å2 / Rmerge(I) obs: 0.09 |
- 解析
解析
| ソフトウェア |
| ||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 精密化 | 構造決定の手法 : MIR/SAD / 解像度: 1.9→20 Å / Isotropic thermal model: TNT / σ(F): 0 / 立体化学のターゲット値: TNT : MIR/SAD / 解像度: 1.9→20 Å / Isotropic thermal model: TNT / σ(F): 0 / 立体化学のターゲット値: TNT詳細: THE FINAL (FO-FC) DENSITY SHOWS LARGE DIFFERENCE FEATURES LOCATED AROUND THE MAIN CHAIN PART OF THE FLUOROPHORE THAT ORIGINATES FROM RESIDUES THR 65 AND GLY 67. THE DIFFERENCE DENSITIES ALSO ...詳細: THE FINAL (FO-FC) DENSITY SHOWS LARGE DIFFERENCE FEATURES LOCATED AROUND THE MAIN CHAIN PART OF THE FLUOROPHORE THAT ORIGINATES FROM RESIDUES THR 65 AND GLY 67. THE DIFFERENCE DENSITIES ALSO AFFECT THE ATOMIC-POSITION REFINEMENT OF VAL 68. THE DIFFERENCE FEATURES MIGHT BE EXPLAINED AS A SUBSET (<30%) OF MOLECULES THAT HAS FAILED TO UNDERGO THE COMPLETE FORMATION OF THE FLUOROPHORE. THE LOOP RESIDUES 157 AND 158 ARE DISORDERED. A NUMBER OF SURFACE RESIDUES HAVE TRUNCATED SIDE CHAINS DUE TO WEAK OR NO DENSITY.
| ||||||||||||||||||||||||||||||||||||||||||||||||||
| 溶媒の処理 | 溶媒モデル: BABINET SCALING / Bsol: 300 Å2 / ksol: 0.8 e/Å3 | ||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化ステップ | サイクル: LAST / 解像度: 1.9→20 Å
| ||||||||||||||||||||||||||||||||||||||||||||||||||
| 拘束条件 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||
| ソフトウェア | *PLUS 名称: TNT / バージョン: 5-F / 分類: refinement | ||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化 | *PLUS Rfactor obs: 0.175 | ||||||||||||||||||||||||||||||||||||||||||||||||||
| 溶媒の処理 | *PLUS | ||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子変位パラメータ | *PLUS Biso mean: 24.1 Å2 | ||||||||||||||||||||||||||||||||||||||||||||||||||
| 拘束条件 | *PLUS
|
 ムービー
ムービー コントローラー
コントローラー




















 PDBj
PDBj


