+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | TehA from Haemophilus influenzae purified in LMNG | |||||||||
 マップデータ マップデータ | ||||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード |  ANION CHANNEL (イオンチャネル) / ALPHA HELICAL INTEGRAL MEMBRANE PROTEIN / ANION CHANNEL (イオンチャネル) / ALPHA HELICAL INTEGRAL MEMBRANE PROTEIN /  MEMBRANE PROTEIN (膜タンパク質) MEMBRANE PROTEIN (膜タンパク質) | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報monoatomic cation efflux transmembrane transporter activity / response to tellurium ion / response to antibiotic / identical protein binding /  細胞膜 細胞膜類似検索 - 分子機能 | |||||||||
| 生物種 |   Haemophilus influenzae (インフルエンザ菌) Haemophilus influenzae (インフルエンザ菌) | |||||||||
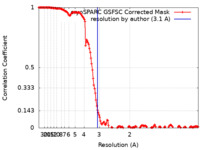
| 手法 |  単粒子再構成法 / 単粒子再構成法 /  クライオ電子顕微鏡法 / 解像度: 3.1 Å クライオ電子顕微鏡法 / 解像度: 3.1 Å | |||||||||
 データ登録者 データ登録者 | Catalano C / Senko S / Tran NL / Lucier KW / Farwell AC / Silva MS / Dip PV / Poweleit N / Scapin G | |||||||||
| 資金援助 | 1件
| |||||||||
 引用 引用 |  ジャーナル: Int J Mol Sci / 年: 2024 ジャーナル: Int J Mol Sci / 年: 2024タイトル: High-Resolution Cryo-Electron Microscopy Structure Determination of Tellurite-Resistance Protein A via 200 kV Transmission Electron Microscopy. 著者: Nhi L Tran / Skerdi Senko / Kyle W Lucier / Ashlyn C Farwell / Sabrina M Silva / Phat V Dip / Nicole Poweleit / Giovanna Scapin / Claudio Catalano /  要旨: Membrane proteins constitute about 20% of the human proteome and play crucial roles in cellular functions. However, a complete understanding of their structure and function is limited by their ...Membrane proteins constitute about 20% of the human proteome and play crucial roles in cellular functions. However, a complete understanding of their structure and function is limited by their hydrophobic nature, which poses significant challenges in purification and stabilization. Detergents, essential in the isolation process, risk destabilizing or altering the proteins' native conformations, thus affecting stability and functionality. This study leverages single-particle cryo-electron microscopy to elucidate the structural nuances of membrane proteins, focusing on the SLAC1 bacterial homolog from (TehA) purified with diverse detergents, including n-dodecyl β-D-maltopyranoside (DDM), glycodiosgenin (GDN), β-D-octyl-glucoside (OG), and lauryl maltose neopentyl glycol (LMNG). This research not only contributes to the understanding of membrane protein structures but also addresses detergent effects on protein purification. By showcasing that the overall structural integrity of the channel is preserved, our study underscores the intricate interplay between proteins and detergents, offering insightful implications for drug design and membrane biology. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_43248.map.gz emd_43248.map.gz | 306.6 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-43248-v30.xml emd-43248-v30.xml emd-43248.xml emd-43248.xml | 16.2 KB 16.2 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_43248_fsc.xml emd_43248_fsc.xml | 14.6 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_43248.png emd_43248.png | 39.4 KB | ||
| マスクデータ |  emd_43248_msk_1.map emd_43248_msk_1.map | 325 MB |  マスクマップ マスクマップ | |
| Filedesc metadata |  emd-43248.cif.gz emd-43248.cif.gz | 5.7 KB | ||
| その他 |  emd_43248_half_map_1.map.gz emd_43248_half_map_1.map.gz emd_43248_half_map_2.map.gz emd_43248_half_map_2.map.gz | 301.7 MB 301.7 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-43248 http://ftp.pdbj.org/pub/emdb/structures/EMD-43248 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-43248 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-43248 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_43248.map.gz / 形式: CCP4 / 大きさ: 325 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_43248.map.gz / 形式: CCP4 / 大きさ: 325 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ボクセルのサイズ | X=Y=Z: 0.566 Å | ||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-マスク #1
| ファイル |  emd_43248_msk_1.map emd_43248_msk_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
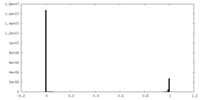
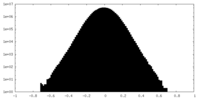
| 密度ヒストグラム |
-ハーフマップ: #1
| ファイル | emd_43248_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
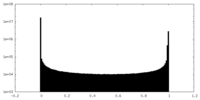
| 密度ヒストグラム |
-ハーフマップ: #2
| ファイル | emd_43248_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
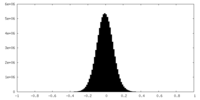
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : TELLURITE RESISTANCE PROTEIN TEHA
| 全体 | 名称: TELLURITE RESISTANCE PROTEIN TEHA |
|---|---|
| 要素 |
|
-超分子 #1: TELLURITE RESISTANCE PROTEIN TEHA
| 超分子 | 名称: TELLURITE RESISTANCE PROTEIN TEHA / タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: all |
|---|---|
| 由来(天然) | 生物種:   Haemophilus influenzae (インフルエンザ菌) Haemophilus influenzae (インフルエンザ菌) |
| 分子量 | 理論値: 108 KDa |
-分子 #1: Tellurite resistance protein TehA homolog
| 分子 | 名称: Tellurite resistance protein TehA homolog / タイプ: protein_or_peptide / ID: 1 / コピー数: 3 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:   Haemophilus influenzae (インフルエンザ菌) Haemophilus influenzae (インフルエンザ菌) |
| 分子量 | 理論値: 35.252547 KDa |
| 組換発現 | 生物種:   Escherichia coli 'BL21-Gold(DE3)pLysS AG' (大腸菌) Escherichia coli 'BL21-Gold(DE3)pLysS AG' (大腸菌) |
| 配列 | 文字列: MNITKPFPLP TGYFGIPLGL AALSLAWFHL ENLFPAARMV SDVLGIVASA VWILFILMYA YKLRYYFEEV RAEYHSPVRF SFIALIPIT TMLVGDILYR WNPLIAEVLI WIGTIGQLLF STLRVSELWQ GGVFEQKSTH PSFYLPAVAA NFTSASSLAL L GYHDLGYL ...文字列: MNITKPFPLP TGYFGIPLGL AALSLAWFHL ENLFPAARMV SDVLGIVASA VWILFILMYA YKLRYYFEEV RAEYHSPVRF SFIALIPIT TMLVGDILYR WNPLIAEVLI WIGTIGQLLF STLRVSELWQ GGVFEQKSTH PSFYLPAVAA NFTSASSLAL L GYHDLGYL FFGAGMIAWI IFEPVLLQHL RISSLEPQFR ATMGIVLAPA FVCVSAYLSI NHGEVDTLAK ILWGYGFLQL FF LLRLFPW IVEKGLNIGL WAFSFGLASM ANSATAFYHG NVLQGVSIFA FVFSNVMIGL LVLMTIYKLT KGQFFLK UniProtKB: Tellurite resistance protein TehA homolog |
-実験情報
-構造解析
| 手法 |  クライオ電子顕微鏡法 クライオ電子顕微鏡法 |
|---|---|
 解析 解析 |  単粒子再構成法 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 3 mg/mL |
|---|---|
| 緩衝液 | pH: 8 |
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 95 % / チャンバー内温度: 277.15 K / 装置: FEI VITROBOT MARK IV |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | TFS GLACIOS |
|---|---|
| 電子線 | 加速電圧: 200 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | C2レンズ絞り径: 50.0 µm / 照射モード: SPOT SCAN / 撮影モード: BRIGHT FIELD Bright-field microscopy / Cs: 2.7 mm / 最大 デフォーカス(公称値): 1.5 µm / 最小 デフォーカス(公称値): 0.5 µm / 倍率(公称値): 240000 Bright-field microscopy / Cs: 2.7 mm / 最大 デフォーカス(公称値): 1.5 µm / 最小 デフォーカス(公称値): 0.5 µm / 倍率(公称値): 240000 |
| 試料ステージ | 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER ホルダー冷却材: NITROGEN |
| 撮影 | フィルム・検出器のモデル: FEI FALCON IV (4k x 4k) 実像数: 11370 / 平均電子線量: 36.43 e/Å2 |
 ムービー
ムービー コントローラー
コントローラー











 Z
Z Y
Y X
X