+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-22131 | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Structure of the human CAK in complex with THZ1 | |||||||||||||||
 マップデータ マップデータ | Post-processed (sharpened, filtered) cryo-EM map, clipped to 134 pixels (as used for coordinate refinement). | |||||||||||||||
 試料 試料 |
| |||||||||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報negative regulation of DNA helicase activity /  ventricular system development / cyclin-dependent protein kinase activating kinase holoenzyme complex / snRNA transcription by RNA polymerase II / CAK-ERCC2 complex / transcription factor TFIIK complex / adult heart development / transcription factor TFIIH core complex / cyclin-dependent protein serine/threonine kinase activator activity / transcription factor TFIIH holo complex ...negative regulation of DNA helicase activity / ventricular system development / cyclin-dependent protein kinase activating kinase holoenzyme complex / snRNA transcription by RNA polymerase II / CAK-ERCC2 complex / transcription factor TFIIK complex / adult heart development / transcription factor TFIIH core complex / cyclin-dependent protein serine/threonine kinase activator activity / transcription factor TFIIH holo complex ...negative regulation of DNA helicase activity /  ventricular system development / cyclin-dependent protein kinase activating kinase holoenzyme complex / snRNA transcription by RNA polymerase II / CAK-ERCC2 complex / transcription factor TFIIK complex / adult heart development / transcription factor TFIIH core complex / cyclin-dependent protein serine/threonine kinase activator activity / transcription factor TFIIH holo complex / [RNA-polymerase]-subunit kinase / RNA Polymerase I Transcription Termination / cyclin-dependent protein serine/threonine kinase regulator activity / RNA Pol II CTD phosphorylation and interaction with CE during HIV infection / RNA Pol II CTD phosphorylation and interaction with CE / Formation of the Early Elongation Complex / Formation of the HIV-1 Early Elongation Complex / mRNA Capping / HIV Transcription Initiation / RNA Polymerase II HIV Promoter Escape / Transcription of the HIV genome / RNA Polymerase II Promoter Escape / RNA Polymerase II Transcription Pre-Initiation And Promoter Opening / RNA Polymerase II Transcription Initiation / RNA Polymerase II Transcription Initiation And Promoter Clearance / regulation of cyclin-dependent protein serine/threonine kinase activity / regulation of G1/S transition of mitotic cell cycle / RNA Polymerase I Transcription Initiation / RNA polymerase II transcribes snRNA genes / Tat-mediated elongation of the HIV-1 transcript / Formation of HIV-1 elongation complex containing HIV-1 Tat / ATP-dependent activity, acting on DNA / ventricular system development / cyclin-dependent protein kinase activating kinase holoenzyme complex / snRNA transcription by RNA polymerase II / CAK-ERCC2 complex / transcription factor TFIIK complex / adult heart development / transcription factor TFIIH core complex / cyclin-dependent protein serine/threonine kinase activator activity / transcription factor TFIIH holo complex / [RNA-polymerase]-subunit kinase / RNA Polymerase I Transcription Termination / cyclin-dependent protein serine/threonine kinase regulator activity / RNA Pol II CTD phosphorylation and interaction with CE during HIV infection / RNA Pol II CTD phosphorylation and interaction with CE / Formation of the Early Elongation Complex / Formation of the HIV-1 Early Elongation Complex / mRNA Capping / HIV Transcription Initiation / RNA Polymerase II HIV Promoter Escape / Transcription of the HIV genome / RNA Polymerase II Promoter Escape / RNA Polymerase II Transcription Pre-Initiation And Promoter Opening / RNA Polymerase II Transcription Initiation / RNA Polymerase II Transcription Initiation And Promoter Clearance / regulation of cyclin-dependent protein serine/threonine kinase activity / regulation of G1/S transition of mitotic cell cycle / RNA Polymerase I Transcription Initiation / RNA polymerase II transcribes snRNA genes / Tat-mediated elongation of the HIV-1 transcript / Formation of HIV-1 elongation complex containing HIV-1 Tat / ATP-dependent activity, acting on DNA /  サイクリン依存性キナーゼ / Formation of HIV elongation complex in the absence of HIV Tat / cyclin-dependent protein serine/threonine kinase activity / Cyclin E associated events during G1/S transition / RNA Polymerase II Transcription Elongation / Cyclin A/B1/B2 associated events during G2/M transition / Formation of RNA Pol II elongation complex / Cyclin A:Cdk2-associated events at S phase entry / RNA Polymerase II Pre-transcription Events / RNA polymerase II CTD heptapeptide repeat kinase activity / male germ cell nucleus / サイクリン依存性キナーゼ / Formation of HIV elongation complex in the absence of HIV Tat / cyclin-dependent protein serine/threonine kinase activity / Cyclin E associated events during G1/S transition / RNA Polymerase II Transcription Elongation / Cyclin A/B1/B2 associated events during G2/M transition / Formation of RNA Pol II elongation complex / Cyclin A:Cdk2-associated events at S phase entry / RNA Polymerase II Pre-transcription Events / RNA polymerase II CTD heptapeptide repeat kinase activity / male germ cell nucleus /  transcription initiation at RNA polymerase II promoter / nucleotide-excision repair / RNA Polymerase I Promoter Escape / TP53 Regulates Transcription of DNA Repair Genes / positive regulation of smooth muscle cell proliferation / NoRC negatively regulates rRNA expression / G1/S transition of mitotic cell cycle / Transcription-Coupled Nucleotide Excision Repair (TC-NER) / Formation of TC-NER Pre-Incision Complex / transcription initiation at RNA polymerase II promoter / nucleotide-excision repair / RNA Polymerase I Promoter Escape / TP53 Regulates Transcription of DNA Repair Genes / positive regulation of smooth muscle cell proliferation / NoRC negatively regulates rRNA expression / G1/S transition of mitotic cell cycle / Transcription-Coupled Nucleotide Excision Repair (TC-NER) / Formation of TC-NER Pre-Incision Complex /  核小体 / Formation of Incision Complex in GG-NER / response to calcium ion / Dual incision in TC-NER / Gap-filling DNA repair synthesis and ligation in TC-NER / Cyclin D associated events in G1 / RUNX1 regulates transcription of genes involved in differentiation of HSCs / protein-containing complex assembly / transcription by RNA polymerase II / protein stabilization / 核小体 / Formation of Incision Complex in GG-NER / response to calcium ion / Dual incision in TC-NER / Gap-filling DNA repair synthesis and ligation in TC-NER / Cyclin D associated events in G1 / RUNX1 regulates transcription of genes involved in differentiation of HSCs / protein-containing complex assembly / transcription by RNA polymerase II / protein stabilization /  regulation of cell cycle / regulation of cell cycle /  protein kinase activity / protein kinase activity /  細胞周期 / 細胞周期 /  リン酸化 / リン酸化 /  細胞分裂 / protein serine kinase activity / 細胞分裂 / protein serine kinase activity /  DNA修復 / protein serine/threonine kinase activity / regulation of transcription by RNA polymerase II / negative regulation of apoptotic process / perinuclear region of cytoplasm / positive regulation of transcription by RNA polymerase II / zinc ion binding / DNA修復 / protein serine/threonine kinase activity / regulation of transcription by RNA polymerase II / negative regulation of apoptotic process / perinuclear region of cytoplasm / positive regulation of transcription by RNA polymerase II / zinc ion binding /  核質 / 核質 /  ATP binding / ATP binding /  細胞核 / 細胞核 /  細胞膜 / 細胞膜 /  細胞質基質 / 細胞質基質 /  細胞質 細胞質類似検索 - 分子機能 | |||||||||||||||
| 生物種 |   Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||||||||
| 手法 |  単粒子再構成法 / 単粒子再構成法 /  クライオ電子顕微鏡法 / 解像度: 3.3 Å クライオ電子顕微鏡法 / 解像度: 3.3 Å | |||||||||||||||
 データ登録者 データ登録者 | Greber BJ / Perez-Bertoldi JM / Lim K / Iavarone AT / Toso DB / Nogales E | |||||||||||||||
| 資金援助 |  米国, 4件 米国, 4件
| |||||||||||||||
 引用 引用 |  ジャーナル: Proc Natl Acad Sci U S A / 年: 2020 ジャーナル: Proc Natl Acad Sci U S A / 年: 2020タイトル: The cryoelectron microscopy structure of the human CDK-activating kinase. 著者: Basil J Greber / Juan M Perez-Bertoldi / Kif Lim / Anthony T Iavarone / Daniel B Toso / Eva Nogales /  要旨: The human CDK-activating kinase (CAK), a complex composed of cyclin-dependent kinase (CDK) 7, cyclin H, and MAT1, is a critical regulator of transcription initiation and the cell cycle. It acts by ...The human CDK-activating kinase (CAK), a complex composed of cyclin-dependent kinase (CDK) 7, cyclin H, and MAT1, is a critical regulator of transcription initiation and the cell cycle. It acts by phosphorylating the C-terminal heptapeptide repeat domain of the RNA polymerase II (Pol II) subunit RPB1, which is an important regulatory event in transcription initiation by Pol II, and it phosphorylates the regulatory T-loop of CDKs that control cell cycle progression. Here, we have determined the three-dimensional (3D) structure of the catalytic module of human CAK, revealing the structural basis of its assembly and providing insight into CDK7 activation in this context. The unique third component of the complex, MAT1, substantially extends the interaction interface between CDK7 and cyclin H, explaining its role as a CAK assembly factor, and it forms interactions with the CDK7 T-loop, which may contribute to enhancing CAK activity. We have also determined the structure of the CAK in complex with the covalently bound inhibitor THZ1 in order to provide insight into the binding of inhibitors at the CDK7 active site and to aid in the rational design of therapeutic compounds. | |||||||||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_22131.map.gz emd_22131.map.gz | 8.5 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-22131-v30.xml emd-22131-v30.xml emd-22131.xml emd-22131.xml | 23.4 KB 23.4 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  emd_22131.png emd_22131.png | 134.1 KB | ||
| マスクデータ |  emd_22131_msk_1.map emd_22131_msk_1.map | 27 MB |  マスクマップ マスクマップ | |
| その他 |  emd_22131_half_map_1.map.gz emd_22131_half_map_1.map.gz emd_22131_half_map_2.map.gz emd_22131_half_map_2.map.gz | 20.7 MB 20.7 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-22131 http://ftp.pdbj.org/pub/emdb/structures/EMD-22131 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-22131 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-22131 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  6xd3MC  6xbzC C: 同じ文献を引用 ( M: このマップから作成された原子モデル |
|---|---|
| 類似構造データ | |
| 電子顕微鏡画像生データ |  EMPIAR-10438 (タイトル: Single-particle cryo-EM of the human CDK-activating kinase in complex with THZ1 EMPIAR-10438 (タイトル: Single-particle cryo-EM of the human CDK-activating kinase in complex with THZ1Data size: 2.4 TB Data #1: Unaligned movies of human CAK-THZ1 [micrographs - multiframe]) |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_22131.map.gz / 形式: CCP4 / 大きさ: 9.2 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_22131.map.gz / 形式: CCP4 / 大きさ: 9.2 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Post-processed (sharpened, filtered) cryo-EM map, clipped to 134 pixels (as used for coordinate refinement). | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.372 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
-マスク #1
| ファイル |  emd_22131_msk_1.map emd_22131_msk_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: Unsharpened half-map (full size, 198 pixels).
| ファイル | emd_22131_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Unsharpened half-map (full size, 198 pixels). | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: Unsharpened half-map (full size, 198 pixels).
| ファイル | emd_22131_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Unsharpened half-map (full size, 198 pixels). | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : CDK-activating kinase assembly factor MAT1, Cyclin-H, Cyclin-depe...
| 全体 | 名称: CDK-activating kinase assembly factor MAT1, Cyclin-H, Cyclin-dependent kinase 7 (E.C.2.7.11.22,2.7.11.23) |
|---|---|
| 要素 |
|
-超分子 #1: CDK-activating kinase assembly factor MAT1, Cyclin-H, Cyclin-depe...
| 超分子 | 名称: CDK-activating kinase assembly factor MAT1, Cyclin-H, Cyclin-dependent kinase 7 (E.C.2.7.11.22,2.7.11.23) タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: #1-#3 詳細: Recombinantly expressed as a trimeric complex in insect cells (MAT1 subunit truncated) and then modified with covalent inhibitor THZ1 |
|---|---|
| 由来(天然) | 生物種:   Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 組換発現 | 生物種:   Trichoplusia ni (イラクサキンウワバ) Trichoplusia ni (イラクサキンウワバ) |
| 分子量 | 理論値: 80 KDa |
-分子 #1: CDK-activating kinase assembly factor MAT1
| 分子 | 名称: CDK-activating kinase assembly factor MAT1 / タイプ: protein_or_peptide / ID: 1 / コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:   Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 10.234531 KDa |
| 組換発現 | 生物種:   Trichoplusia ni (イラクサキンウワバ) Trichoplusia ni (イラクサキンウワバ) |
| 配列 | 文字列: SNAPVTFSTG IKMGQHISLA PIHKLEEALY EYQPLQIETY GPHVPELEML GRLGYLNHVR AASPQDLAGG YTSSLACHRA LQDAFSGLF WQPS |
-分子 #2: Cyclin-H
| 分子 | 名称: Cyclin-H / タイプ: protein_or_peptide / ID: 2 / コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:   Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 37.695473 KDa |
| 組換発現 | 生物種:   Trichoplusia ni (イラクサキンウワバ) Trichoplusia ni (イラクサキンウワバ) |
| 配列 | 文字列: MYHNSSQKRH WTFSSEEQLA RLRADANRKF RCKAVANGKV LPNDPVFLEP HEEMTLCKYY EKRLLEFCSV FKPAMPRSVV GTACMYFKR FYLNNSVMEY HPRIIMLTCA FLACKVDEFN VSSPQFVGNL RESPLGQEKA LEQILEYELL LIQQLNFHLI V HNPYRPFE ...文字列: MYHNSSQKRH WTFSSEEQLA RLRADANRKF RCKAVANGKV LPNDPVFLEP HEEMTLCKYY EKRLLEFCSV FKPAMPRSVV GTACMYFKR FYLNNSVMEY HPRIIMLTCA FLACKVDEFN VSSPQFVGNL RESPLGQEKA LEQILEYELL LIQQLNFHLI V HNPYRPFE GFLIDLKTRY PILENPEILR KTADDFLNRI ALTDAYLLYT PSQIALTAIL SSASRAGITM ESYLSESLML KE NRTCLSQ LLDIMKSMRN LVKKYEPPRS EEVAVLKQKL ERCHSAELAL NVITKKRKGY EDDDYVSKKS KHEEEEWTDD DLV ESL |
-分子 #3: Cyclin-dependent kinase 7
| 分子 | 名称: Cyclin-dependent kinase 7 / タイプ: protein_or_peptide / ID: 3 / コピー数: 1 / 光学異性体: LEVO / EC番号:  サイクリン依存性キナーゼ サイクリン依存性キナーゼ |
|---|---|
| 由来(天然) | 生物種:   Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 39.442574 KDa |
| 組換発現 | 生物種:   Trichoplusia ni (イラクサキンウワバ) Trichoplusia ni (イラクサキンウワバ) |
| 配列 | 文字列: SNAMALDVKS RAKRYEKLDF LGEGQFATVY KARDKNTNQI VAIKKIKLGH RSEAKDGINR TALREIKLLQ ELSHPNIIGL LDAFGHKSN ISLVFDFMET DLEVIIKDNS LVLTPSHIKA YMLMTLQGLE YLHQHWILHR DLKPNNLLLD ENGVLKLADF G LAKSFG(SEP) ...文字列: SNAMALDVKS RAKRYEKLDF LGEGQFATVY KARDKNTNQI VAIKKIKLGH RSEAKDGINR TALREIKLLQ ELSHPNIIGL LDAFGHKSN ISLVFDFMET DLEVIIKDNS LVLTPSHIKA YMLMTLQGLE YLHQHWILHR DLKPNNLLLD ENGVLKLADF G LAKSFG(SEP)P NRAYTHQVVT RWYRAPELLF GARMYGVGVD MWAVGCILAE LLLRVPFLPG DSDLDQLTRI FETLGTPT E EQWPDMCSLP DYVTFKSFPG IPLHHIFSAA GDDLLDLIQG LFLFNPCARI TATQALKMKY FSNRPGPTPG CQLPRPNCP VETLKEQSNP ALAIKRKRTE ALEQGGLPKK LIF |
-分子 #4: N-(3-{[5-chloro-4-(1H-indol-3-yl)pyrimidin-2-yl]amino}phenyl)-4-{...
| 分子 | 名称: N-(3-{[5-chloro-4-(1H-indol-3-yl)pyrimidin-2-yl]amino}phenyl)-4-{[4-(dimethylamino)butanoyl]amino}benzamide タイプ: ligand / ID: 4 / コピー数: 1 / 式: V0G |
|---|---|
| 分子量 | 理論値: 568.069 Da |
| Chemical component information | 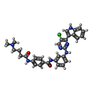 ChemComp-V0G: |
-実験情報
-構造解析
| 手法 |  クライオ電子顕微鏡法 クライオ電子顕微鏡法 |
|---|---|
 解析 解析 |  単粒子再構成法 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 0.2 mg/mL | ||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 緩衝液 | pH: 7.9 構成要素:
| ||||||||||||||||||
| グリッド | モデル: UltrAuFoil R1.2/1.3 / 材質: GOLD / 支持フィルム - 材質: GOLD / 支持フィルム - トポロジー: HOLEY / 前処理 - タイプ: PLASMA CLEANING / 前処理 - 雰囲気: AIR | ||||||||||||||||||
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 100 % / チャンバー内温度: 278 K / 装置: FEI VITROBOT MARK IV |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TALOS ARCTICA |
|---|---|
| 電子線 | 加速電圧: 200 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | C2レンズ絞り径: 50.0 µm / 倍率(補正後): 72886 / 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD Bright-field microscopy / Cs: 2.7 mm / 最大 デフォーカス(公称値): 2.5 µm / 最小 デフォーカス(公称値): 0.3 µm Bright-field microscopy / Cs: 2.7 mm / 最大 デフォーカス(公称値): 2.5 µm / 最小 デフォーカス(公称値): 0.3 µm |
| 試料ステージ | 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER ホルダー冷却材: NITROGEN |
| 撮影 | フィルム・検出器のモデル: GATAN K3 (6k x 4k) / 撮影したグリッド数: 1 / 実像数: 5007 / 平均露光時間: 2.0 sec. / 平均電子線量: 69.0 e/Å2 / 詳細: 69 frames per movie |
| 実験機器 |  モデル: Talos Arctica / 画像提供: FEI Company |
- 画像解析
画像解析
| 粒子像選択 | 選択した数: 4884787 / 詳細: 3D-template picking |
|---|---|
| CTF補正 | ソフトウェア: (名称: RELION (ver. 3.1), CTFFIND (ver. 4)) 詳細: CTF estimation with CTFFIND4, CTF correction in RELION 3.1 during reconstruction. |
| 初期モデル | モデルのタイプ: EMDB MAP EMDB ID: |
| 初期 角度割当 | タイプ: MAXIMUM LIKELIHOOD / ソフトウェア - 名称: RELION (ver. 3.1) |
| 最終 3次元分類 | ソフトウェア - 名称: RELION (ver. 3.1) |
| 最終 角度割当 | タイプ: MAXIMUM LIKELIHOOD / ソフトウェア - 名称: RELION (ver. 3.1) |
| 最終 再構成 | 想定した対称性 - 点群: C1 (非対称) / 解像度のタイプ: BY AUTHOR / 解像度: 3.3 Å / 解像度の算出法: FSC 0.143 CUT-OFF / ソフトウェア - 名称: RELION (ver. 3.1) / 使用した粒子像数: 31198 |
 ムービー
ムービー コントローラー
コントローラー





























 Z
Z Y
Y X
X