+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 8e9i | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Mycobacterial respiratory complex I, semi-inserted quinone | |||||||||||||||
 要素 要素 |
| |||||||||||||||
 キーワード キーワード |  MEMBRANE PROTEIN (膜タンパク質) / MEMBRANE PROTEIN (膜タンパク質) /  Complex / Complex /  Oxidative Phosphorylation (酸化的リン酸化) / Oxidative Phosphorylation (酸化的リン酸化) /  NADH-quinone oxidoreductase (NADHデヒドロゲナーゼ (キノン)) / NADH-quinone oxidoreductase (NADHデヒドロゲナーゼ (キノン)) /  Iron-sulfur Protein (鉄硫黄タンパク質) Iron-sulfur Protein (鉄硫黄タンパク質) | |||||||||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報 NADHデヒドロゲナーゼ (キノン) / トランスロカーゼ; ヒドロンの輸送の触媒; 酸化還元酵素反応を伴う / NADH:ubiquinone reductase (non-electrogenic) activity / molybdopterin cofactor binding / oxidoreductase activity, acting on NAD(P)H, quinone or similar compound as acceptor / respiratory chain complex I / phosphorelay signal transduction system / NADHデヒドロゲナーゼ (キノン) / トランスロカーゼ; ヒドロンの輸送の触媒; 酸化還元酵素反応を伴う / NADH:ubiquinone reductase (non-electrogenic) activity / molybdopterin cofactor binding / oxidoreductase activity, acting on NAD(P)H, quinone or similar compound as acceptor / respiratory chain complex I / phosphorelay signal transduction system /  NADH dehydrogenase (ubiquinone) activity / NADH dehydrogenase (ubiquinone) activity /  quinone binding / ATP synthesis coupled electron transport ... quinone binding / ATP synthesis coupled electron transport ... NADHデヒドロゲナーゼ (キノン) / トランスロカーゼ; ヒドロンの輸送の触媒; 酸化還元酵素反応を伴う / NADH:ubiquinone reductase (non-electrogenic) activity / molybdopterin cofactor binding / oxidoreductase activity, acting on NAD(P)H, quinone or similar compound as acceptor / respiratory chain complex I / phosphorelay signal transduction system / NADHデヒドロゲナーゼ (キノン) / トランスロカーゼ; ヒドロンの輸送の触媒; 酸化還元酵素反応を伴う / NADH:ubiquinone reductase (non-electrogenic) activity / molybdopterin cofactor binding / oxidoreductase activity, acting on NAD(P)H, quinone or similar compound as acceptor / respiratory chain complex I / phosphorelay signal transduction system /  NADH dehydrogenase (ubiquinone) activity / NADH dehydrogenase (ubiquinone) activity /  quinone binding / ATP synthesis coupled electron transport / 2 iron, 2 sulfur cluster binding / NAD binding / FMN binding / 4 iron, 4 sulfur cluster binding / quinone binding / ATP synthesis coupled electron transport / 2 iron, 2 sulfur cluster binding / NAD binding / FMN binding / 4 iron, 4 sulfur cluster binding /  oxidoreductase activity / iron ion binding / oxidoreductase activity / iron ion binding /  生体膜 / 生体膜 /  metal ion binding / metal ion binding /  細胞膜 細胞膜類似検索 - 分子機能 | |||||||||||||||
| 生物種 |  Mycolicibacterium smegmatis MC2 155 (バクテリア) Mycolicibacterium smegmatis MC2 155 (バクテリア) | |||||||||||||||
| 手法 |  電子顕微鏡法 / 電子顕微鏡法 /  単粒子再構成法 / 単粒子再構成法 /  クライオ電子顕微鏡法 / 解像度: 2.8 Å クライオ電子顕微鏡法 / 解像度: 2.8 Å | |||||||||||||||
 データ登録者 データ登録者 | Liang, Y. / Rubinstein, J.L. | |||||||||||||||
| 資金援助 |  カナダ, 4件 カナダ, 4件
| |||||||||||||||
 引用 引用 |  ジャーナル: Proc Natl Acad Sci U S A / 年: 2023 ジャーナル: Proc Natl Acad Sci U S A / 年: 2023タイトル: Structure of mycobacterial respiratory complex I. 著者: Yingke Liang / Alicia Plourde / Stephanie A Bueler / Jun Liu / Peter Brzezinski / Siavash Vahidi / John L Rubinstein /   要旨: Oxidative phosphorylation, the combined activity of the electron transport chain (ETC) and adenosine triphosphate synthase, has emerged as a valuable target for the treatment of infection by and ...Oxidative phosphorylation, the combined activity of the electron transport chain (ETC) and adenosine triphosphate synthase, has emerged as a valuable target for the treatment of infection by and other mycobacteria. The mycobacterial ETC is highly branched with multiple dehydrogenases transferring electrons to a membrane-bound pool of menaquinone and multiple oxidases transferring electrons from the pool. The proton-pumping type I nicotinamide adenine dinucleotide (NADH) dehydrogenase (Complex I) is found in low abundance in the plasma membranes of mycobacteria in typical in vitro culture conditions and is often considered dispensable. We found that growth of in carbon-limited conditions greatly increased the abundance of Complex I and allowed isolation of a rotenone-sensitive preparation of the enzyme. Determination of the structure of the complex by cryoEM revealed the "orphan" two-component response regulator protein MSMEG_2064 as a subunit of the assembly. MSMEG_2064 in the complex occupies a site similar to the proposed redox-sensing subunit NDUFA9 in eukaryotic Complex I. An apparent purine nucleoside triphosphate within the NuoG subunit resembles the GTP-derived molybdenum cofactor in homologous formate dehydrogenase enzymes. The membrane region of the complex binds acyl phosphatidylinositol dimannoside, a characteristic three-tailed lipid from the mycobacterial membrane. The structure also shows menaquinone, which is preferentially used over ubiquinone by gram-positive bacteria, in two different positions along the quinone channel, comparable to ubiquinone in other structures and suggesting a conserved quinone binding mechanism. #1:  ジャーナル: Biorxiv / 年: 2022 ジャーナル: Biorxiv / 年: 2022タイトル: Structure of mycobacterial respiratory Complex I 著者: Liang, Y. / Plourde, A. / Bueler, S.A. / Liu, J. / Brzezinski, P. / Vahidi, S. / Rubinstein, J.L. | |||||||||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  8e9i.cif.gz 8e9i.cif.gz | 817.9 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb8e9i.ent.gz pdb8e9i.ent.gz | 648.7 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  8e9i.json.gz 8e9i.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/e9/8e9i https://data.pdbj.org/pub/pdb/validation_reports/e9/8e9i ftp://data.pdbj.org/pub/pdb/validation_reports/e9/8e9i ftp://data.pdbj.org/pub/pdb/validation_reports/e9/8e9i | HTTPS FTP |
|---|
-関連構造データ
| 関連構造データ | 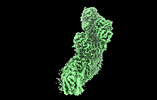 27965MC  8e9gC  8e9hC M: このデータのモデリングに利用したマップデータ C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
|
|---|---|
| 1 |
|
- 要素
要素
-タンパク質 , 1種, 1分子 O
| #1: タンパク質 |  Two-component regulatory system Two-component regulatory system分子量: 14119.161 Da / 分子数: 1 / 由来タイプ: 天然 由来: (天然)  Mycolicibacterium smegmatis MC2 155 (バクテリア) Mycolicibacterium smegmatis MC2 155 (バクテリア)株: ATCC 700084 / mc(2)155 / 参照: UniProt: A0QU37 |
|---|
-NADH-quinone oxidoreductase subunit ... , 12種, 12分子 BACDEGFIHJKN
| #2: タンパク質 |  NADHデヒドロゲナーゼ (キノン) / NADH dehydrogenase I subunit B / NDH-1 subunit B NADHデヒドロゲナーゼ (キノン) / NADH dehydrogenase I subunit B / NDH-1 subunit B分子量: 20123.703 Da / 分子数: 1 / 由来タイプ: 天然 由来: (天然)  Mycolicibacterium smegmatis MC2 155 (バクテリア) Mycolicibacterium smegmatis MC2 155 (バクテリア)株: ATCC 700084 / mc(2)155 参照: UniProt: A0QU35, トランスロカーゼ; ヒドロンの輸送の触媒; 酸化還元酵素反応を伴う |
|---|---|
| #3: タンパク質 |  NADHデヒドロゲナーゼ (キノン) / NADH dehydrogenase I subunit A / NDH-1 subunit A / NUO1 NADHデヒドロゲナーゼ (キノン) / NADH dehydrogenase I subunit A / NDH-1 subunit A / NUO1分子量: 13628.287 Da / 分子数: 1 / 由来タイプ: 天然 由来: (天然)  Mycolicibacterium smegmatis MC2 155 (バクテリア) Mycolicibacterium smegmatis MC2 155 (バクテリア)株: ATCC 700084 / mc(2)155 参照: UniProt: A0QU36, トランスロカーゼ; ヒドロンの輸送の触媒; 酸化還元酵素反応を伴う |
| #4: タンパク質 |  NADHデヒドロゲナーゼ (キノン) / NADH dehydrogenase I subunit C / NDH-1 subunit C NADHデヒドロゲナーゼ (キノン) / NADH dehydrogenase I subunit C / NDH-1 subunit C分子量: 26610.689 Da / 分子数: 1 / 由来タイプ: 天然 由来: (天然)  Mycolicibacterium smegmatis MC2 155 (バクテリア) Mycolicibacterium smegmatis MC2 155 (バクテリア)株: ATCC 700084 / mc(2)155 参照: UniProt: A0QU34, トランスロカーゼ; ヒドロンの輸送の触媒; 酸化還元酵素反応を伴う |
| #5: タンパク質 |  NADHデヒドロゲナーゼ (キノン) / NADH dehydrogenase I subunit D / NDH-1 subunit D NADHデヒドロゲナーゼ (キノン) / NADH dehydrogenase I subunit D / NDH-1 subunit D分子量: 48556.750 Da / 分子数: 1 / 由来タイプ: 天然 由来: (天然)  Mycolicibacterium smegmatis MC2 155 (バクテリア) Mycolicibacterium smegmatis MC2 155 (バクテリア)株: ATCC 700084 / mc(2)155 参照: UniProt: A0QU33, トランスロカーゼ; ヒドロンの輸送の触媒; 酸化還元酵素反応を伴う |
| #6: タンパク質 |  NADHデヒドロゲナーゼ (キノン) NADHデヒドロゲナーゼ (キノン)分子量: 25746.746 Da / 分子数: 1 / 由来タイプ: 天然 由来: (天然)  Mycolicibacterium smegmatis MC2 155 (バクテリア) Mycolicibacterium smegmatis MC2 155 (バクテリア)株: ATCC 700084 / mc(2)155 参照: UniProt: A0QU32,  NADHデヒドロゲナーゼ (キノン) NADHデヒドロゲナーゼ (キノン) |
| #7: タンパク質 |  NADHデヒドロゲナーゼ (キノン) NADHデヒドロゲナーゼ (キノン)分子量: 83894.773 Da / 分子数: 1 / 由来タイプ: 天然 由来: (天然)  Mycolicibacterium smegmatis MC2 155 (バクテリア) Mycolicibacterium smegmatis MC2 155 (バクテリア)株: ATCC 700084 / mc(2)155 参照: UniProt: A0QU30, トランスロカーゼ; ヒドロンの輸送の触媒; 酸化還元酵素反応を伴う |
| #8: タンパク質 |  NADHデヒドロゲナーゼ (キノン) NADHデヒドロゲナーゼ (キノン)分子量: 47831.078 Da / 分子数: 1 / 由来タイプ: 天然 由来: (天然)  Mycolicibacterium smegmatis MC2 155 (バクテリア) Mycolicibacterium smegmatis MC2 155 (バクテリア)株: ATCC 700084 / mc(2)155 参照: UniProt: A0QU31, トランスロカーゼ; ヒドロンの輸送の触媒; 酸化還元酵素反応を伴う |
| #9: タンパク質 |  NADHデヒドロゲナーゼ (キノン) / NADH dehydrogenase I subunit I / NDH-1 subunit I NADHデヒドロゲナーゼ (キノン) / NADH dehydrogenase I subunit I / NDH-1 subunit I分子量: 19860.510 Da / 分子数: 1 / 由来タイプ: 天然 由来: (天然)  Mycolicibacterium smegmatis MC2 155 (バクテリア) Mycolicibacterium smegmatis MC2 155 (バクテリア)株: ATCC 700084 / mc(2)155 参照: UniProt: A0QU28, トランスロカーゼ; ヒドロンの輸送の触媒; 酸化還元酵素反応を伴う |
| #10: タンパク質 |  NADHデヒドロゲナーゼ (キノン) / NADH dehydrogenase I subunit H / NDH-1 subunit H NADHデヒドロゲナーゼ (キノン) / NADH dehydrogenase I subunit H / NDH-1 subunit H分子量: 44477.293 Da / 分子数: 1 / 由来タイプ: 天然 由来: (天然)  Mycolicibacterium smegmatis MC2 155 (バクテリア) Mycolicibacterium smegmatis MC2 155 (バクテリア)株: ATCC 700084 / mc(2)155 参照: UniProt: A0QU29, トランスロカーゼ; ヒドロンの輸送の触媒; 酸化還元酵素反応を伴う |
| #11: タンパク質 |  NADHデヒドロゲナーゼ (キノン) NADHデヒドロゲナーゼ (キノン)分子量: 26398.791 Da / 分子数: 1 / 由来タイプ: 天然 由来: (天然)  Mycolicibacterium smegmatis MC2 155 (バクテリア) Mycolicibacterium smegmatis MC2 155 (バクテリア)株: ATCC 700084 / mc(2)155 参照: UniProt: A0QU27, トランスロカーゼ; ヒドロンの輸送の触媒; 酸化還元酵素反応を伴う |
| #12: タンパク質 |  NADHデヒドロゲナーゼ (キノン) / NADH dehydrogenase I subunit K / NDH-1 subunit K NADHデヒドロゲナーゼ (キノン) / NADH dehydrogenase I subunit K / NDH-1 subunit K分子量: 10876.923 Da / 分子数: 1 / 由来タイプ: 天然 由来: (天然)  Mycolicibacterium smegmatis MC2 155 (バクテリア) Mycolicibacterium smegmatis MC2 155 (バクテリア)株: ATCC 700084 / mc(2)155 参照: UniProt: A0QU26, トランスロカーゼ; ヒドロンの輸送の触媒; 酸化還元酵素反応を伴う |
| #14: タンパク質 |  NADHデヒドロゲナーゼ (キノン) / NADH dehydrogenase I subunit N / NDH-1 subunit N NADHデヒドロゲナーゼ (キノン) / NADH dehydrogenase I subunit N / NDH-1 subunit N分子量: 54013.266 Da / 分子数: 1 / 由来タイプ: 天然 由来: (天然)  Mycolicibacterium smegmatis MC2 155 (バクテリア) Mycolicibacterium smegmatis MC2 155 (バクテリア)株: ATCC 700084 / mc(2)155 参照: UniProt: A0QU23, トランスロカーゼ; ヒドロンの輸送の触媒; 酸化還元酵素反応を伴う |
-NADH-quinone oxidoreductase, ... , 2種, 2分子 LM
| #13: タンパク質 |  NADHデヒドロゲナーゼ (キノン) NADHデヒドロゲナーゼ (キノン)分子量: 65446.609 Da / 分子数: 1 / 由来タイプ: 天然 由来: (天然)  Mycolicibacterium smegmatis MC2 155 (バクテリア) Mycolicibacterium smegmatis MC2 155 (バクテリア)株: ATCC 700084 / mc(2)155 参照: UniProt: A0QU25,  NADHデヒドロゲナーゼ (キノン) NADHデヒドロゲナーゼ (キノン) |
|---|---|
| #15: タンパク質 |  NADHデヒドロゲナーゼ (キノン) NADHデヒドロゲナーゼ (キノン)分子量: 56338.316 Da / 分子数: 1 / 由来タイプ: 天然 由来: (天然)  Mycolicibacterium smegmatis MC2 155 (バクテリア) Mycolicibacterium smegmatis MC2 155 (バクテリア)株: ATCC 700084 / mc(2)155 参照: UniProt: A0QU24,  NADHデヒドロゲナーゼ (キノン) NADHデヒドロゲナーゼ (キノン) |
-非ポリマー , 7種, 14分子 




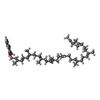







| #16: 化合物 | ChemComp-SF4 /  鉄・硫黄クラスター 鉄・硫黄クラスター#17: 化合物 |  鉄・硫黄クラスター 鉄・硫黄クラスター#18: 化合物 | ChemComp-GTP / |  グアノシン三リン酸 グアノシン三リン酸#19: 化合物 | ChemComp-FMN / |  フラビンモノヌクレオチド フラビンモノヌクレオチド#20: 化合物 | ChemComp-ZN / | #21: 化合物 | ChemComp-MQ9 / |  メナキノン メナキノン#22: 化合物 | ChemComp-XP2 / ( | |
|---|
-詳細
| 研究の焦点であるリガンドがあるか | Y |
|---|
-実験情報
-実験
| 実験 | 手法:  電子顕微鏡法 電子顕微鏡法 |
|---|---|
| EM実験 | 試料の集合状態: PARTICLE / 3次元再構成法:  単粒子再構成法 単粒子再構成法 |
- 試料調製
試料調製
| 構成要素 | 名称: Mycobacterial respiratory complex I, semi-inserted quinone タイプ: COMPLEX / Entity ID: #1-#15 / 由来: NATURAL |
|---|---|
| 分子量 | 値: 0.56 MDa / 実験値: NO |
| 由来(天然) | 生物種:  Mycolicibacterium smegmatis MC2 155 (バクテリア) Mycolicibacterium smegmatis MC2 155 (バクテリア)細胞内の位置: Inner membrane |
| 緩衝液 | pH: 6 |
| 試料 | 濃度: 2 mg/ml / 包埋: NO / シャドウイング: NO / 染色 : NO / 凍結 : NO / 凍結 : YES : YES |
| 試料支持 | グリッドの材料: COPPER/RHODIUM / グリッドのサイズ: 400 divisions/in. / グリッドのタイプ: Homemade |
急速凍結 | 装置: LEICA EM GP / 凍結剤: ETHANE / 湿度: 100 % / 凍結前の試料温度: 277 K |
- 電子顕微鏡撮影
電子顕微鏡撮影
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
|---|---|
| 顕微鏡 | モデル: FEI TITAN KRIOS |
| 電子銃 | 電子線源 : :  FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: FLOOD BEAM FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: FLOOD BEAM |
| 電子レンズ | モード: BRIGHT FIELD Bright-field microscopy / 倍率(公称値): 75000 X / 最大 デフォーカス(公称値): 2200 nm / 最小 デフォーカス(公称値): 800 nm Bright-field microscopy / 倍率(公称値): 75000 X / 最大 デフォーカス(公称値): 2200 nm / 最小 デフォーカス(公称値): 800 nm |
| 試料ホルダ | 凍結剤: NITROGEN 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER |
| 撮影 | 電子線照射量: 47 e/Å2 フィルム・検出器のモデル: FEI FALCON IV (4k x 4k) |
- 解析
解析
| ソフトウェア | 名称: PHENIX / バージョン: 1.19.2_4158: / 分類: 精密化 | ||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| EMソフトウェア |
| ||||||||||||||||||||||||
CTF補正 | タイプ: PHASE FLIPPING AND AMPLITUDE CORRECTION | ||||||||||||||||||||||||
| 対称性 | 点対称性 : C1 (非対称) : C1 (非対称) | ||||||||||||||||||||||||
3次元再構成 | 解像度: 2.8 Å / 解像度の算出法: FSC 0.143 CUT-OFF / 粒子像の数: 14385 / 対称性のタイプ: POINT | ||||||||||||||||||||||||
| 拘束条件 |
|
 ムービー
ムービー コントローラー
コントローラー




 PDBj
PDBj






















