+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 7y04 | ||||||
|---|---|---|---|---|---|---|---|
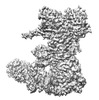
| タイトル | Hsp90-AhR-p23 complex | ||||||
 要素 要素 |
| ||||||
 キーワード キーワード |  CYTOSOLIC PROTEIN (細胞質基質) / CYTOSOLIC PROTEIN (細胞質基質) /  Hsp90 (Hsp90) / AhR / Hsp90 (Hsp90) / AhR /  complex / p23 complex / p23 | ||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報circumferential growth involved in left ventricle morphogenesis / negative regulation of calcium ion transmembrane transport / cellular response to 3-methylcholanthrene / regulation of heart growth / ESR-mediated signaling / negative regulation of T cell mediated immune response to tumor cell / cytosolic aryl hydrocarbon receptor complex / glomerulus morphogenesis / DDX58/IFIH1-mediated induction of interferon-alpha/beta / The NLRP3 inflammasome ...circumferential growth involved in left ventricle morphogenesis / negative regulation of calcium ion transmembrane transport / cellular response to 3-methylcholanthrene / regulation of heart growth / ESR-mediated signaling / negative regulation of T cell mediated immune response to tumor cell / cytosolic aryl hydrocarbon receptor complex / glomerulus morphogenesis / DDX58/IFIH1-mediated induction of interferon-alpha/beta / The NLRP3 inflammasome / gland development / HSF1-dependent transactivation / regulation of B cell proliferation / reactive oxygen species biosynthetic process / Phase I - Functionalization of compounds /  生体異物 / Aryl hydrocarbon receptor signalling / HSF1 activation / kidney morphogenesis / RHOBTB2 GTPase cycle / lung saccule development / cellular response to molecule of bacterial origin / omega-hydroxylase P450 pathway / 生体異物 / Aryl hydrocarbon receptor signalling / HSF1 activation / kidney morphogenesis / RHOBTB2 GTPase cycle / lung saccule development / cellular response to molecule of bacterial origin / omega-hydroxylase P450 pathway /  卵細胞 / Sema3A PAK dependent Axon repulsion / 卵細胞 / Sema3A PAK dependent Axon repulsion /  prostaglandin-E synthase / prostaglandin-E synthase /  prostaglandin-E synthase activity / arachidonic acid omega-hydroxylase activity / prostaglandin-E synthase activity / arachidonic acid omega-hydroxylase activity /  central nervous system neuron axonogenesis / positive regulation of growth rate / lymphocyte homeostasis / Attenuation phase / central nervous system neuron axonogenesis / positive regulation of growth rate / lymphocyte homeostasis / Attenuation phase /  regulation of adaptive immune response / regulation of adaptive immune response /  : / : /  : / HSP90 chaperone cycle for steroid hormone receptors (SHR) in the presence of ligand / negative regulation of complement-dependent cytotoxicity / cellular response to 2,3,7,8-tetrachlorodibenzodioxine / : / HSP90 chaperone cycle for steroid hormone receptors (SHR) in the presence of ligand / negative regulation of complement-dependent cytotoxicity / cellular response to 2,3,7,8-tetrachlorodibenzodioxine /  telomerase activity / Endogenous sterols / nuclear aryl hydrocarbon receptor complex / Synthesis of Prostaglandins (PG) and Thromboxanes (TX) / HSP90-CDC37 chaperone complex / positive regulation of cyclin-dependent protein kinase activity / intracellular glucocorticoid receptor signaling pathway / cardiac left ventricle morphogenesis / The role of GTSE1 in G2/M progression after G2 checkpoint / sperm head plasma membrane / negative regulation of proteasomal protein catabolic process / negative regulation of osteoblast proliferation / cellular response to toxic substance / reproductive structure development / prostate gland development / telomerase activity / Endogenous sterols / nuclear aryl hydrocarbon receptor complex / Synthesis of Prostaglandins (PG) and Thromboxanes (TX) / HSP90-CDC37 chaperone complex / positive regulation of cyclin-dependent protein kinase activity / intracellular glucocorticoid receptor signaling pathway / cardiac left ventricle morphogenesis / The role of GTSE1 in G2/M progression after G2 checkpoint / sperm head plasma membrane / negative regulation of proteasomal protein catabolic process / negative regulation of osteoblast proliferation / cellular response to toxic substance / reproductive structure development / prostate gland development /  aryl hydrocarbon receptor complex / dynein axonemal particle / Regulation of actin dynamics for phagocytic cup formation / aryl hydrocarbon receptor complex / dynein axonemal particle / Regulation of actin dynamics for phagocytic cup formation /  histone methyltransferase binding / B-1 B cell homeostasis / Estrogen-dependent gene expression / post-embryonic hemopoiesis / histone methyltransferase binding / B-1 B cell homeostasis / Estrogen-dependent gene expression / post-embryonic hemopoiesis /  COP9 signalosome / positive regulation of protein localization to cell surface / negative regulation of DNA biosynthetic process / ATP-dependent protein binding / camera-type eye development / vasculature development / axon extension / negative regulation of systemic arterial blood pressure / glycogen biosynthetic process / COP9 signalosome / positive regulation of protein localization to cell surface / negative regulation of DNA biosynthetic process / ATP-dependent protein binding / camera-type eye development / vasculature development / axon extension / negative regulation of systemic arterial blood pressure / glycogen biosynthetic process /  telomerase holoenzyme complex / protein folding chaperone complex / telomerase holoenzyme complex / protein folding chaperone complex /  循環器 / blood vessel morphogenesis / prostaglandin biosynthetic process / 循環器 / blood vessel morphogenesis / prostaglandin biosynthetic process /  dATP binding / dATP binding /  sulfonylurea receptor binding / CTP binding / negative regulation of protein metabolic process / skin development / UTP binding / negative regulation of vasoconstriction / branching involved in blood vessel morphogenesis / sulfonylurea receptor binding / CTP binding / negative regulation of protein metabolic process / skin development / UTP binding / negative regulation of vasoconstriction / branching involved in blood vessel morphogenesis /  telomerase holoenzyme complex assembly / establishment of cell polarity / telomerase holoenzyme complex assembly / establishment of cell polarity /  immune system process / prostaglandin metabolic process / immune system process / prostaglandin metabolic process /  heterocyclic compound binding / TPR domain binding / blood vessel development / heterocyclic compound binding / TPR domain binding / blood vessel development /  E-box binding / T cell homeostasis / positive regulation of transforming growth factor beta receptor signaling pathway / dendritic growth cone / chaperone cofactor-dependent protein refolding / positive regulation of phosphoprotein phosphatase activity / TFIID-class transcription factor complex binding / E-box binding / T cell homeostasis / positive regulation of transforming growth factor beta receptor signaling pathway / dendritic growth cone / chaperone cofactor-dependent protein refolding / positive regulation of phosphoprotein phosphatase activity / TFIID-class transcription factor complex binding /  aryl hydrocarbon receptor binding / B cell homeostasis / cAMP-mediated signaling / regulation of protein ubiquitination aryl hydrocarbon receptor binding / B cell homeostasis / cAMP-mediated signaling / regulation of protein ubiquitination類似検索 - 分子機能 | ||||||
| 生物種 |   Mus musculus (ハツカネズミ) Mus musculus (ハツカネズミ) | ||||||
| 手法 |  電子顕微鏡法 / 電子顕微鏡法 /  単粒子再構成法 / 単粒子再構成法 /  クライオ電子顕微鏡法 / 解像度: 3.5 Å クライオ電子顕微鏡法 / 解像度: 3.5 Å | ||||||
 データ登録者 データ登録者 | Wen, Z.L. / Zhai, Y.J. / Zhu, Y. / Sun, F. | ||||||
| 資金援助 | 1件
| ||||||
 引用 引用 |  ジャーナル: Structure / 年: 2023 ジャーナル: Structure / 年: 2023タイトル: Cryo-EM structure of the cytosolic AhR complex. 著者: Zuoling Wen / Yuebin Zhang / Beirong Zhang / Yumo Hang / Li Xu / Yangsheng Chen / Qunhui Xie / Qun Zhao / Lihua Zhang / Guohui Li / Bin Zhao / Fei Sun / Yujia Zhai / Yun Zhu /  要旨: Aryl hydrocarbon receptor (AhR) is an important ligand-activated transcription factor involved in the regulation of various important physiological functions. Here, we report the cryo-EM structures ...Aryl hydrocarbon receptor (AhR) is an important ligand-activated transcription factor involved in the regulation of various important physiological functions. Here, we report the cryo-EM structures of the Hsp90-AhR-p23 complex with or without bound XAP2, where the structure of the mouse AhR PAS-B domain is resolved. A highly conserved bridge motif of AhR is responsible for the interaction with the Hsp90 dimeric lumen. The ligand-free AhR PAS-B domain is attached to the Hsp90 dimer and is stabilized in the complex with bound XAP2. In addition, the DE-loop and a group of conserved pocket inner residues in the AhR PAS-B domain are found to be important for ligand binding. These results reveal the structural basis of the biological functions of AhR. Moreover, the protein purification method presented here allows the isolation of stable mouse AhR protein, which could be used to develop high-sensitivity biosensors for environmental pollutant detection. | ||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  7y04.cif.gz 7y04.cif.gz | 281.3 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb7y04.ent.gz pdb7y04.ent.gz | 222.1 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  7y04.json.gz 7y04.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/y0/7y04 https://data.pdbj.org/pub/pdb/validation_reports/y0/7y04 ftp://data.pdbj.org/pub/pdb/validation_reports/y0/7y04 ftp://data.pdbj.org/pub/pdb/validation_reports/y0/7y04 | HTTPS FTP |
|---|
-関連構造データ
| 関連構造データ |  33537MC  8h77C M: このデータのモデリングに利用したマップデータ C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
|
|---|---|
| 1 |
|
- 要素
要素
| #1: タンパク質 |  Heat shock response / Heat shock 84 kDa / HSP 84 / HSP84 / Tumor-specific transplantation 84 kDa antigen / TSTA Heat shock response / Heat shock 84 kDa / HSP 84 / HSP84 / Tumor-specific transplantation 84 kDa antigen / TSTA分子量: 86590.688 Da / 分子数: 2 / 由来タイプ: 組換発現 / 由来: (組換発現)   Mus musculus (ハツカネズミ) / 遺伝子: Hsp90ab1, Hsp84, Hsp84-1, Hspcb Mus musculus (ハツカネズミ) / 遺伝子: Hsp90ab1, Hsp84, Hsp84-1, Hspcb発現宿主:   Spodoptera frugiperda (ツマジロクサヨトウ) Spodoptera frugiperda (ツマジロクサヨトウ)参照: UniProt: P11499 #2: タンパク質 |  / Cytosolic prostaglandin E2 synthase / cPGES / Hsp90 co-chaperone / Progesterone receptor complex ...Cytosolic prostaglandin E2 synthase / cPGES / Hsp90 co-chaperone / Progesterone receptor complex p23 / Sid 3177 / Telomerase-binding protein p23 / Cytosolic prostaglandin E2 synthase / cPGES / Hsp90 co-chaperone / Progesterone receptor complex ...Cytosolic prostaglandin E2 synthase / cPGES / Hsp90 co-chaperone / Progesterone receptor complex p23 / Sid 3177 / Telomerase-binding protein p23分子量: 20133.994 Da / 分子数: 2 / 由来タイプ: 組換発現 / 由来: (組換発現)   Mus musculus (ハツカネズミ) / 遺伝子: Ptges3, Sid3177, Tebp Mus musculus (ハツカネズミ) / 遺伝子: Ptges3, Sid3177, Tebp発現宿主:   Spodoptera frugiperda (ツマジロクサヨトウ) Spodoptera frugiperda (ツマジロクサヨトウ)参照: UniProt: Q9R0Q7,  prostaglandin-E synthase prostaglandin-E synthase#3: タンパク質 | |  芳香族炭化水素受容体 芳香族炭化水素受容体分子量: 46138.473 Da / 分子数: 1 / 由来タイプ: 組換発現 / 由来: (組換発現)   Mus musculus (ハツカネズミ) Mus musculus (ハツカネズミ)発現宿主:   Spodoptera frugiperda (ツマジロクサヨトウ) Spodoptera frugiperda (ツマジロクサヨトウ)参照: UniProt: P30561 #4: 化合物 |  アデノシン二リン酸 アデノシン二リン酸#5: 化合物 | 研究の焦点であるリガンドがあるか | N | |
|---|
-実験情報
-実験
| 実験 | 手法:  電子顕微鏡法 電子顕微鏡法 |
|---|---|
| EM実験 | 試料の集合状態: PARTICLE / 3次元再構成法:  単粒子再構成法 単粒子再構成法 |
- 試料調製
試料調製
| 構成要素 |
| |||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 由来(天然) |
| |||||||||||||||||||||||||||||||||||
| 由来(組換発現) |
| |||||||||||||||||||||||||||||||||||
| 緩衝液 | pH: 7.5 | |||||||||||||||||||||||||||||||||||
| 試料 | 包埋: NO / シャドウイング: NO / 染色 : NO / 凍結 : NO / 凍結 : YES : YES | |||||||||||||||||||||||||||||||||||
急速凍結 | 凍結剤: ETHANE |
- 電子顕微鏡撮影
電子顕微鏡撮影
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
|---|---|
| 顕微鏡 | モデル: FEI TITAN KRIOS |
| 電子銃 | 電子線源 : :  FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: FLOOD BEAM FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: FLOOD BEAM |
| 電子レンズ | モード: BRIGHT FIELD Bright-field microscopy / 最大 デフォーカス(公称値): 2000 nm / 最小 デフォーカス(公称値): 1300 nm Bright-field microscopy / 最大 デフォーカス(公称値): 2000 nm / 最小 デフォーカス(公称値): 1300 nm |
| 撮影 | 電子線照射量: 60 e/Å2 / フィルム・検出器のモデル: GATAN K3 (6k x 4k) |
- 解析
解析
| ソフトウェア | 名称: PHENIX / バージョン: 1.19.2_4158: / 分類: 精密化 | ||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
CTF補正 | タイプ: PHASE FLIPPING AND AMPLITUDE CORRECTION | ||||||||||||||||||||||||
3次元再構成 | 解像度: 3.5 Å / 解像度の算出法: FSC 0.143 CUT-OFF / 粒子像の数: 291578 / 対称性のタイプ: POINT | ||||||||||||||||||||||||
| 拘束条件 |
|
 ムービー
ムービー コントローラー
コントローラー



 PDBj
PDBj



























