+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-9779 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Reconstruction of HRPV6 VP5 spike | |||||||||
 マップデータ マップデータ | ||||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | HRPV6 / spike /  envelope protein (エンベロープ (ウイルス)) / envelope protein (エンベロープ (ウイルス)) /  fusion protein (融合タンパク質) / fusion protein (融合タンパク質) /  archaea (古細菌) / archaea (古細菌) /  haloarchaea (高度好塩菌) / haloarchaea (高度好塩菌) /  VIRAL PROTEIN (ウイルスタンパク質) VIRAL PROTEIN (ウイルスタンパク質) | |||||||||
| 機能・相同性 | Twin arginine translocation (Tat) signal profile. /  Twin-arginine translocation pathway, signal sequence / Twin-arginine translocation pathway, signal sequence /  生体膜 / VP5 生体膜 / VP5 機能・相同性情報 機能・相同性情報 | |||||||||
| 生物種 |  Halorubrum pleomorphic virus 6 (ウイルス) / Halorubrum pleomorphic virus 6 (ウイルス) /   Halorubrum (古細菌) Halorubrum (古細菌) | |||||||||
| 手法 | サブトモグラム平均法 /  クライオ電子顕微鏡法 / 解像度: 16.0 Å クライオ電子顕微鏡法 / 解像度: 16.0 Å | |||||||||
 データ登録者 データ登録者 | Li S / Huiskonen JT | |||||||||
| 資金援助 |  英国, 1件 英国, 1件
| |||||||||
 引用 引用 |  ジャーナル: Nat Commun / 年: 2019 ジャーナル: Nat Commun / 年: 2019タイトル: The structure of a prokaryotic viral envelope protein expands the landscape of membrane fusion proteins. 著者: Kamel El Omari / Sai Li / Abhay Kotecha / Thomas S Walter / Eduardo A Bignon / Karl Harlos / Pentti Somerharju / Felix De Haas / Daniel K Clare / Mika Molin / Felipe Hurtado / Mengqiu Li / ...著者: Kamel El Omari / Sai Li / Abhay Kotecha / Thomas S Walter / Eduardo A Bignon / Karl Harlos / Pentti Somerharju / Felix De Haas / Daniel K Clare / Mika Molin / Felipe Hurtado / Mengqiu Li / Jonathan M Grimes / Dennis H Bamford / Nicole D Tischler / Juha T Huiskonen / David I Stuart / Elina Roine /      要旨: Lipid membrane fusion is an essential function in many biological processes. Detailed mechanisms of membrane fusion and the protein structures involved have been mainly studied in eukaryotic systems, ...Lipid membrane fusion is an essential function in many biological processes. Detailed mechanisms of membrane fusion and the protein structures involved have been mainly studied in eukaryotic systems, whereas very little is known about membrane fusion in prokaryotes. Haloarchaeal pleomorphic viruses (HRPVs) have a membrane envelope decorated with spikes that are presumed to be responsible for host attachment and membrane fusion. Here we determine atomic structures of the ectodomains of the 57-kDa spike protein VP5 from two related HRPVs revealing a previously unreported V-shaped fold. By Volta phase plate cryo-electron tomography we show that VP5 is monomeric on the viral surface, and we establish the orientation of the molecules with respect to the viral membrane. We also show that the viral membrane fuses with the host cytoplasmic membrane in a process mediated by VP5. This sheds light on protein structures involved in prokaryotic membrane fusion. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_9779.map.gz emd_9779.map.gz | 7.3 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-9779-v30.xml emd-9779-v30.xml emd-9779.xml emd-9779.xml | 16.3 KB 16.3 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_9779_fsc.xml emd_9779_fsc.xml | 5.1 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_9779.png emd_9779.png | 39.1 KB | ||
| マスクデータ |  emd_9779_msk_1.map emd_9779_msk_1.map | 8 MB |  マスクマップ マスクマップ | |
| Filedesc metadata |  emd-9779.cif.gz emd-9779.cif.gz | 6.1 KB | ||
| その他 |  emd_9779_half_map_1.map.gz emd_9779_half_map_1.map.gz emd_9779_half_map_2.map.gz emd_9779_half_map_2.map.gz | 7.3 MB 7.3 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-9779 http://ftp.pdbj.org/pub/emdb/structures/EMD-9779 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-9779 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-9779 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_9779.map.gz / 形式: CCP4 / 大きさ: 8 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_9779.map.gz / 形式: CCP4 / 大きさ: 8 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 2.24 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
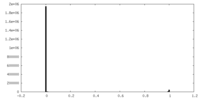
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
-マスク #1
| ファイル |  emd_9779_msk_1.map emd_9779_msk_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
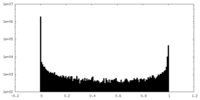
| 密度ヒストグラム |
-ハーフマップ: #1
| ファイル | emd_9779_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
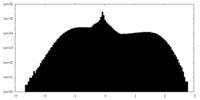
| 密度ヒストグラム |
-ハーフマップ: #2
| ファイル | emd_9779_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
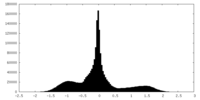
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : Halorubrum
| 全体 | 名称:   Halorubrum (古細菌) Halorubrum (古細菌) |
|---|---|
| 要素 |
|
-超分子 #1: Halorubrum
| 超分子 | 名称: Halorubrum / タイプ: virus / ID: 1 / 親要素: 0 / 含まれる分子: all / NCBI-ID: 56688 / 生物種: Halorubrum / ウイルスタイプ: VIRION / ウイルス・単離状態: SPECIES / ウイルス・エンベロープ: Yes / ウイルス・中空状態: No |
|---|---|
| 宿主 | 生物種:   Halorubrum (古細菌) Halorubrum (古細菌) |
| 分子量 | 理論値: 57 KDa |
| ウイルス殻 | Shell ID: 1 / 名称: Envelope |
-分子 #1: VP5
| 分子 | 名称: VP5 / タイプ: protein_or_peptide / ID: 1 / コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Halorubrum pleomorphic virus 6 (ウイルス) Halorubrum pleomorphic virus 6 (ウイルス) |
| 分子量 | 理論値: 57.333914 KDa |
| 配列 | 文字列: IAPLVGYAIG AAAISAVGGI GVGWTLREFE VVGSDDPAEG LTPDVLRNQL SDSVVKRKSN NQSTMVDNQN ILDGVEHTAY TEAKIAAIE ELNAGSSESA VLSAANSAID SYETTVRTNF YKSWNETVRE LEAMTQTVIA HADVGLSYIT DFGDPRFGNL A SGTSPNTL ...文字列: IAPLVGYAIG AAAISAVGGI GVGWTLREFE VVGSDDPAEG LTPDVLRNQL SDSVVKRKSN NQSTMVDNQN ILDGVEHTAY TEAKIAAIE ELNAGSSESA VLSAANSAID SYETTVRTNF YKSWNETVRE LEAMTQTVIA HADVGLSYIT DFGDPRFGNL A SGTSPNTL KDTTVSMPDG TNFTLLTFRH NTGWDSGNAA YSVVEYNPKE VVTSTNSNTY NTVDGTQYMK FSEWNAVETE MD TVFQNVR NGISTWVTNV YGDVQSGAIE ISDLVTPRER ATMMAQEEGM SQAIADLIAL NVPVDAEREA TITIQDTGAT LPG TFALTD SSDGPLSAGQ TYDPSTFSGD VYFTADMSLV EGPWDAINSG VDGGTITITS EPYEGTAIEV TTVESETVSV PAAD WTDNG DGTWSYDASG DLETTITNVD SARFVSTATE TTYDTLQLKG AFTVDKLVNK QSGEEVSSTS FTSSEPQTDS NYITQ DEWD QLEQQNKELI EKYEQSQSGG GLDLGGLDMF GVPGEMVAVG AAAVIGFLML GNN UniProtKB: VP5 |
-実験情報
-構造解析
| 手法 |  クライオ電子顕微鏡法 クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | サブトモグラム平均法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 緩衝液 | pH: 7.2 / 構成要素 - 濃度: 1.6 M / 構成要素 - 式: NaCl 塩化ナトリウム / 構成要素 - 名称: sodium chloride 塩化ナトリウム / 構成要素 - 名称: sodium chloride 塩化ナトリウム 塩化ナトリウム |
|---|---|
| 凍結 | 凍結剤: ETHANE |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD Bright-field microscopy Bright-field microscopy |
| 特殊光学系 | 位相板: VOLTA PHASE PLATE / エネルギーフィルター - 名称: GIF Quantum LS / エネルギーフィルター - スリット幅: 20 eV |
| 撮影 | フィルム・検出器のモデル: GATAN K2 QUANTUM (4k x 4k) 平均露光時間: 1.6 sec. / 平均電子線量: 1.6 e/Å2 |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
 ムービー
ムービー コントローラー
コントローラー














 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)