+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-4894 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Single particle cryo-EM reconstruction of a 16-mer assembly of reduced recombinant human alphaA-crystallin. | |||||||||
 マップデータ マップデータ | Single particle cryo-EM reconstruction of a 16-mer assembly of reduced recombinant human alphaA-crystallin. | |||||||||
 試料 試料 |
| |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報negative regulation of intracellular transport / structural constituent of eye lens / response to stimulus /  視覚 / unfolded protein binding / protein stabilization / negative regulation of apoptotic process / structural molecule activity / protein-containing complex / 視覚 / unfolded protein binding / protein stabilization / negative regulation of apoptotic process / structural molecule activity / protein-containing complex /  核質 ...negative regulation of intracellular transport / structural constituent of eye lens / response to stimulus / 核質 ...negative regulation of intracellular transport / structural constituent of eye lens / response to stimulus /  視覚 / unfolded protein binding / protein stabilization / negative regulation of apoptotic process / structural molecule activity / protein-containing complex / 視覚 / unfolded protein binding / protein stabilization / negative regulation of apoptotic process / structural molecule activity / protein-containing complex /  核質 / identical protein binding / 核質 / identical protein binding /  metal ion binding / metal ion binding /  細胞核 / 細胞核 /  細胞質基質 / 細胞質基質 /  細胞質 細胞質類似検索 - 分子機能 | |||||||||
| 生物種 |   Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||
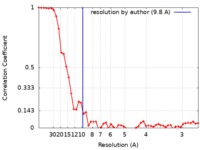
| 手法 |  単粒子再構成法 / 単粒子再構成法 /  クライオ電子顕微鏡法 / 解像度: 9.8 Å クライオ電子顕微鏡法 / 解像度: 9.8 Å | |||||||||
 データ登録者 データ登録者 | Peters C / Kaiser CJO / Buchner J / Weinkauf S | |||||||||
| 資金援助 |  ドイツ, 2件 ドイツ, 2件
| |||||||||
 引用 引用 |  ジャーナル: Nat Struct Mol Biol / 年: 2019 ジャーナル: Nat Struct Mol Biol / 年: 2019タイトル: The structure and oxidation of the eye lens chaperone αA-crystallin. 著者: Christoph J O Kaiser / Carsten Peters / Philipp W N Schmid / Maria Stavropoulou / Juan Zou / Vinay Dahiya / Evgeny V Mymrikov / Beate Rockel / Sam Asami / Martin Haslbeck / Juri Rappsilber / ...著者: Christoph J O Kaiser / Carsten Peters / Philipp W N Schmid / Maria Stavropoulou / Juan Zou / Vinay Dahiya / Evgeny V Mymrikov / Beate Rockel / Sam Asami / Martin Haslbeck / Juri Rappsilber / Bernd Reif / Martin Zacharias / Johannes Buchner / Sevil Weinkauf /   要旨: The small heat shock protein αA-crystallin is a molecular chaperone important for the optical properties of the vertebrate eye lens. It forms heterogeneous oligomeric ensembles. We determined the ...The small heat shock protein αA-crystallin is a molecular chaperone important for the optical properties of the vertebrate eye lens. It forms heterogeneous oligomeric ensembles. We determined the structures of human αA-crystallin oligomers by combining cryo-electron microscopy, cross-linking/mass spectrometry, NMR spectroscopy and molecular modeling. The different oligomers can be interconverted by the addition or subtraction of tetramers, leading to mainly 12-, 16- and 20-meric assemblies in which interactions between N-terminal regions are important. Cross-dimer domain-swapping of the C-terminal region is a determinant of αA-crystallin heterogeneity. Human αA-crystallin contains two cysteines, which can form an intramolecular disulfide in vivo. Oxidation in vitro requires conformational changes and oligomer dissociation. The oxidized oligomers, which are larger than reduced αA-crystallin and destabilized against unfolding, are active chaperones and can transfer the disulfide to destabilized substrate proteins. The insight into the structure and function of αA-crystallin provides a basis for understanding its role in the eye lens. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_4894.map.gz emd_4894.map.gz | 7.6 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-4894-v30.xml emd-4894-v30.xml emd-4894.xml emd-4894.xml | 15.8 KB 15.8 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_4894_fsc.xml emd_4894_fsc.xml | 5.4 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_4894.png emd_4894.png | 71.4 KB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-4894 http://ftp.pdbj.org/pub/emdb/structures/EMD-4894 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-4894 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-4894 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_4894.map.gz / 形式: CCP4 / 大きさ: 8 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_4894.map.gz / 形式: CCP4 / 大きさ: 8 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Single particle cryo-EM reconstruction of a 16-mer assembly of reduced recombinant human alphaA-crystallin. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.35 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
- 試料の構成要素
試料の構成要素
-全体 : Reduced recombinant human alphaA-crystallin
| 全体 | 名称: Reduced recombinant human alphaA-crystallin |
|---|---|
| 要素 |
|
-超分子 #1: Reduced recombinant human alphaA-crystallin
| 超分子 | 名称: Reduced recombinant human alphaA-crystallin / タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: all 詳細: Recombinant wild type full-length human alphaA-crystallin purified in the presence of reductant. |
|---|---|
| 由来(天然) | 生物種:   Homo sapiens (ヒト) / 器官: eye / 組織: lens / 細胞中の位置: cytoplasm Homo sapiens (ヒト) / 器官: eye / 組織: lens / 細胞中の位置: cytoplasm |
| 組換発現 | 生物種:   Escherichia coli BL21 (大腸菌) / 組換プラスミド: pET28 Escherichia coli BL21 (大腸菌) / 組換プラスミド: pET28 |
| 分子量 | 理論値: 319 KDa |
-分子 #1: alphaA-crystallin
| 分子 | 名称: alphaA-crystallin / タイプ: protein_or_peptide / ID: 1 / 詳細: Wild type full sequence / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:   Homo sapiens (ヒト) / 器官: eye / 組織: lens Homo sapiens (ヒト) / 器官: eye / 組織: lens |
| 組換発現 | 生物種:   Escherichia coli BL21 (大腸菌) Escherichia coli BL21 (大腸菌) |
| 配列 | 文字列: MDVTIQHPWF KRTLGPFYPS RLFDQFFGEG LFEYDLLPFL SSTISPYYRQ SLFRTVLDSG ISEVRSDRD KFVIFLDVKH FSPEDLTVKV QDDFVEIHGK HNERQDDHGY ISREFHRRYR L PSNVDQSA LSCSLSADGM LTFCGPKIQT GLDATHAERA IPVSREEKPT SAPSS |
-実験情報
-構造解析
| 手法 |  クライオ電子顕微鏡法 クライオ電子顕微鏡法 |
|---|---|
 解析 解析 |  単粒子再構成法 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 0.3 mg/mL | |||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 緩衝液 | pH: 7.4 構成要素:
詳細: Buffer was prepared without EDTA and DTT. EDTA stock (500mM) was titrated to pH 8 and added to 1 mM. DTT stock (1M) was added to 1mM. | |||||||||||||||||||||
| グリッド | モデル: Quantifoil R2/1 / 材質: COPPER / メッシュ: 200 / 支持フィルム - 材質: CARBON / 支持フィルム - トポロジー: HOLEY ARRAY / 前処理 - タイプ: GLOW DISCHARGE / 前処理 - 雰囲気: AIR / 前処理 - 気圧: 0.007 kPa | |||||||||||||||||||||
| 凍結 | 凍結剤: ETHANE / チャンバー内温度: 293 K / 装置: HOMEMADE PLUNGER 詳細: Diluted equilibrated specimen was added to glow-discharged (30s) grids. Sample was blotted 30s after sample application and immediately plunged.. | |||||||||||||||||||||
| 詳細 | Specimen was thawed, diluted to the final concentration and equilibrated at 310K for 3h. |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | C2レンズ絞り径: 70.0 µm / 倍率(補正後): 37037 / 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD Bright-field microscopy / Cs: 2.7 mm / 最大 デフォーカス(公称値): 2.5 µm / 最小 デフォーカス(公称値): 1.2 µm / 倍率(公称値): 37000 Bright-field microscopy / Cs: 2.7 mm / 最大 デフォーカス(公称値): 2.5 µm / 最小 デフォーカス(公称値): 1.2 µm / 倍率(公称値): 37000 |
| 特殊光学系 | エネルギーフィルター - スリット幅: 10 eV |
| 試料ステージ | 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER ホルダー冷却材: NITROGEN |
| 撮影 | フィルム・検出器のモデル: GATAN K2 SUMMIT (4k x 4k) 検出モード: SUPER-RESOLUTION / デジタル化 - 画像ごとのフレーム数: 1-10 / 撮影したグリッド数: 3 / 平均露光時間: 3.2 sec. / 平均電子線量: 30.0 e/Å2 |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
 ムービー
ムービー コントローラー
コントローラー