+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | ||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Human retinal variant phosphomimetic IMPDH1(595)-S477D free octamer bound by GTP, ATP, IMP, and NAD+ | ||||||||||||||||||
 マップデータ マップデータ | Sharpened map from CryoSPARC | ||||||||||||||||||
 試料 試料 |
| ||||||||||||||||||
 キーワード キーワード |  dehydrogenase (脱水素酵素) / nucleotide synthesis / dehydrogenase (脱水素酵素) / nucleotide synthesis /  cytosol (細胞質基質) / phosphomimetic / cytosol (細胞質基質) / phosphomimetic /  OXIDOREDUCTASE (酸化還元酵素) OXIDOREDUCTASE (酸化還元酵素) | ||||||||||||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報Purine ribonucleoside monophosphate biosynthesis /  IMP dehydrogenase activity / IMP dehydrogenase activity /  IMPデヒドロゲナーゼ / GMP biosynthetic process / Azathioprine ADME / GTP biosynthetic process / azurophil granule lumen / secretory granule lumen / ficolin-1-rich granule lumen / Potential therapeutics for SARS ...Purine ribonucleoside monophosphate biosynthesis / IMPデヒドロゲナーゼ / GMP biosynthetic process / Azathioprine ADME / GTP biosynthetic process / azurophil granule lumen / secretory granule lumen / ficolin-1-rich granule lumen / Potential therapeutics for SARS ...Purine ribonucleoside monophosphate biosynthesis /  IMP dehydrogenase activity / IMP dehydrogenase activity /  IMPデヒドロゲナーゼ / GMP biosynthetic process / Azathioprine ADME / GTP biosynthetic process / azurophil granule lumen / secretory granule lumen / ficolin-1-rich granule lumen / Potential therapeutics for SARS / IMPデヒドロゲナーゼ / GMP biosynthetic process / Azathioprine ADME / GTP biosynthetic process / azurophil granule lumen / secretory granule lumen / ficolin-1-rich granule lumen / Potential therapeutics for SARS /  nucleic acid binding / nucleic acid binding /  nucleotide binding / Neutrophil degranulation / nucleotide binding / Neutrophil degranulation /  DNA binding / DNA binding /  RNA binding / extracellular region / identical protein binding / RNA binding / extracellular region / identical protein binding /  metal ion binding / metal ion binding /  細胞核 / 細胞核 /  細胞質基質 / 細胞質基質 /  細胞質 細胞質類似検索 - 分子機能 | ||||||||||||||||||
| 生物種 |   Homo sapiens (ヒト) Homo sapiens (ヒト) | ||||||||||||||||||
| 手法 |  単粒子再構成法 / 単粒子再構成法 /  クライオ電子顕微鏡法 / 解像度: 3.1 Å クライオ電子顕微鏡法 / 解像度: 3.1 Å | ||||||||||||||||||
 データ登録者 データ登録者 | Calise SJ / Kollman JM | ||||||||||||||||||
| 資金援助 |  米国, 5件 米国, 5件
| ||||||||||||||||||
 引用 引用 |  ジャーナル: J Cell Biol / 年: 2024 ジャーナル: J Cell Biol / 年: 2024タイトル: Light-sensitive phosphorylation regulates retinal IMPDH1 activity and filament assembly. 著者: S John Calise / Audrey G O'Neill / Anika L Burrell / Miles S Dickinson / Josephine Molfino / Charlie Clarke / Joel Quispe / David Sokolov / Rubén M Buey / Justin M Kollman /   要旨: Inosine monophosphate dehydrogenase (IMPDH) is the rate-limiting enzyme in guanosine triphosphate (GTP) synthesis and assembles into filaments in cells, which desensitizes the enzyme to feedback ...Inosine monophosphate dehydrogenase (IMPDH) is the rate-limiting enzyme in guanosine triphosphate (GTP) synthesis and assembles into filaments in cells, which desensitizes the enzyme to feedback inhibition and boosts nucleotide production. The vertebrate retina expresses two splice variants IMPDH1(546) and IMPDH1(595). In bovine retinas, residue S477 is preferentially phosphorylated in the dark, but the effects on IMPDH1 activity and regulation are unclear. Here, we generated phosphomimetic mutants to investigate structural and functional consequences of S477 phosphorylation. The S477D mutation resensitized both variants to GTP inhibition but only blocked assembly of IMPDH1(595) filaments. Cryo-EM structures of both variants showed that S477D specifically blocks assembly of a high-activity assembly interface, still allowing assembly of low-activity IMPDH1(546) filaments. Finally, we discovered that S477D exerts a dominant-negative effect in cells, preventing endogenous IMPDH filament assembly. By modulating the structure and higher-order assembly of IMPDH, S477 phosphorylation acts as a mechanism for downregulating retinal GTP synthesis in the dark when nucleotide turnover is decreased. | ||||||||||||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_41986.map.gz emd_41986.map.gz | 230.2 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-41986-v30.xml emd-41986-v30.xml emd-41986.xml emd-41986.xml | 18.2 KB 18.2 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  emd_41986.png emd_41986.png | 113.6 KB | ||
| Filedesc metadata |  emd-41986.cif.gz emd-41986.cif.gz | 6.4 KB | ||
| その他 |  emd_41986_half_map_1.map.gz emd_41986_half_map_1.map.gz emd_41986_half_map_2.map.gz emd_41986_half_map_2.map.gz | 226.1 MB 226.1 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-41986 http://ftp.pdbj.org/pub/emdb/structures/EMD-41986 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-41986 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-41986 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_41986.map.gz / 形式: CCP4 / 大きさ: 244.1 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_41986.map.gz / 形式: CCP4 / 大きさ: 244.1 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Sharpened map from CryoSPARC | ||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.16 Å | ||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-ハーフマップ: Half map 1
| ファイル | emd_41986_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Half map 1 | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: Half map 2
| ファイル | emd_41986_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Half map 2 | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : IMPDH1(595)-S477D octamer bound by GTP, ATP, IMP, and NAD+
| 全体 | 名称: IMPDH1(595)-S477D octamer bound by GTP, ATP, IMP, and NAD+ |
|---|---|
| 要素 |
|
-超分子 #1: IMPDH1(595)-S477D octamer bound by GTP, ATP, IMP, and NAD+
| 超分子 | 名称: IMPDH1(595)-S477D octamer bound by GTP, ATP, IMP, and NAD+ タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: #1 |
|---|---|
| 由来(天然) | 生物種:   Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 508 KDa |
-分子 #1: Inosine-5'-monophosphate dehydrogenase 1
| 分子 | 名称: Inosine-5'-monophosphate dehydrogenase 1 / タイプ: protein_or_peptide / ID: 1 / コピー数: 8 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:   Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 63.579449 KDa |
| 組換発現 | 生物種:   Escherichia coli BL21(DE3) (大腸菌) Escherichia coli BL21(DE3) (大腸菌) |
| 配列 | 文字列: GSMEGPLTPP PLQGGGAAAV PEPGARQHPG HETAAQRYSA RLLQAGYEPE SMADYLISGG TGYVPEDGLT AQQLFASADG LTYNDFLIL PGFIDFIADE VDLTSALTRK ITLKTPLISS PMDTVTEADM AIAMALMGGI GFIHHNCTPE FQANEVRKVK K FEQGFITD ...文字列: GSMEGPLTPP PLQGGGAAAV PEPGARQHPG HETAAQRYSA RLLQAGYEPE SMADYLISGG TGYVPEDGLT AQQLFASADG LTYNDFLIL PGFIDFIADE VDLTSALTRK ITLKTPLISS PMDTVTEADM AIAMALMGGI GFIHHNCTPE FQANEVRKVK K FEQGFITD PVVLSPSHTV GDVLEAKMRH GFSGIPITET GTMGSKLVGI VTSRDIDFLA EKDHTTLLSE VMTPRIELVV AP AGVTLKE ANEILQRSKK GKLPIVNDCD ELVAIIARTD LKKNRDYPLA SKDSQKQLLC GAAVGTREDD KYRLDLLTQA GVD VIVLDS SQGNSVYQIA MVHYIKQKYP HLQVIGGNVV TAAQAKNLID AGVDGLRVGM GCGSICITQE VMACGRPQGT AVYK VAEYA RRFGVPIIAD GGIQTVGHVV KALALGASTV MMGSLLAATT EAPGEYFFSD GVRLKKYRGM GSLDAMEKSS SSQKR YFSE GDKVKIAQGV SGSIQDKGSI QKFVPYLIAG IQHGCQDIGA RSLDVLRSMM YSGELKFEKR TMSAQIEGGV HGLHSY TFL PFTKSGCTED SGGGRGGGGD APQCPLLGTA SLHN UniProtKB: Inosine-5'-monophosphate dehydrogenase 1 |
-分子 #2: GUANOSINE-5'-TRIPHOSPHATE
| 分子 | 名称: GUANOSINE-5'-TRIPHOSPHATE / タイプ: ligand / ID: 2 / コピー数: 16 / 式: GTP |
|---|---|
| 分子量 | 理論値: 523.18 Da |
| Chemical component information |  ChemComp-GTP: |
-分子 #3: ADENOSINE-5'-TRIPHOSPHATE
| 分子 | 名称: ADENOSINE-5'-TRIPHOSPHATE / タイプ: ligand / ID: 3 / コピー数: 8 / 式: ATP |
|---|---|
| 分子量 | 理論値: 507.181 Da |
| Chemical component information |  ChemComp-ATP: |
-分子 #4: INOSINIC ACID
| 分子 | 名称: INOSINIC ACID / タイプ: ligand / ID: 4 / コピー数: 8 / 式: IMP |
|---|---|
| 分子量 | 理論値: 348.206 Da |
| Chemical component information | 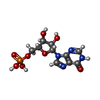 ChemComp-I: |
-分子 #5: NICOTINAMIDE-ADENINE-DINUCLEOTIDE
| 分子 | 名称: NICOTINAMIDE-ADENINE-DINUCLEOTIDE / タイプ: ligand / ID: 5 / コピー数: 8 / 式: NAD |
|---|---|
| 分子量 | 理論値: 663.425 Da |
| Chemical component information |  ChemComp-NAD: |
-実験情報
-構造解析
| 手法 |  クライオ電子顕微鏡法 クライオ電子顕微鏡法 |
|---|---|
 解析 解析 |  単粒子再構成法 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 緩衝液 | pH: 7 |
|---|---|
| グリッド | モデル: C-flat-2/2 / 材質: COPPER / 前処理 - タイプ: GLOW DISCHARGE |
| 凍結 | 凍結剤: ETHANE / 装置: FEI VITROBOT MARK IV |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | TFS GLACIOS |
|---|---|
| 電子線 | 加速電圧: 200 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD Bright-field microscopy / Cs: 2.7 mm / 最大 デフォーカス(公称値): 1.8 µm / 最小 デフォーカス(公称値): 1.2 µm / 倍率(公称値): 36000 Bright-field microscopy / Cs: 2.7 mm / 最大 デフォーカス(公称値): 1.8 µm / 最小 デフォーカス(公称値): 1.2 µm / 倍率(公称値): 36000 |
| 撮影 | フィルム・検出器のモデル: GATAN K2 SUMMIT (4k x 4k) 検出モード: COUNTING / 実像数: 646 / 平均電子線量: 65.0 e/Å2 |
- 画像解析
画像解析
| 粒子像選択 | 選択した数: 343619 |
|---|---|
| 初期モデル | モデルのタイプ: OTHER / 詳細: stochastic gradient descent-generated model |
| 初期 角度割当 | タイプ: MAXIMUM LIKELIHOOD / ソフトウェア - 名称: cryoSPARC |
| 最終 角度割当 | タイプ: MAXIMUM LIKELIHOOD / ソフトウェア - 名称: cryoSPARC |
| 最終 再構成 | 想定した対称性 - 点群: D4 (2回x4回 2面回転対称 ) )解像度のタイプ: BY AUTHOR / 解像度: 3.1 Å / 解像度の算出法: FSC 0.143 CUT-OFF / ソフトウェア - 名称: cryoSPARC / 使用した粒子像数: 163814 |
 ムービー
ムービー コントローラー
コントローラー














 Z
Z Y
Y X
X