+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
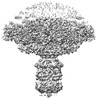
| タイトル | Mature virion portal vertex of bacteriophage lambda | |||||||||
 マップデータ マップデータ | ||||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード |  caudovirales (カウドウイルス) / caudovirales (カウドウイルス) /  siphoviridae (サイフォウイルス科) / portal / siphoviridae (サイフォウイルス科) / portal /  capsid (カプシド) / connector/neck / capsid (カプシド) / connector/neck /  tail (尾) / delivery device / tail (尾) / delivery device /  B-DNA / B-DNA /  phage lambda / phage lambda /  VIRAL PROTEIN (ウイルスタンパク質) VIRAL PROTEIN (ウイルスタンパク質) | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報 viral capsid, decoration / symbiont genome ejection through host cell envelope, long flexible tail mechanism / viral portal complex / viral tail assembly / viral DNA genome packaging / virus tail / T=7 icosahedral viral capsid / viral capsid, decoration / symbiont genome ejection through host cell envelope, long flexible tail mechanism / viral portal complex / viral tail assembly / viral DNA genome packaging / virus tail / T=7 icosahedral viral capsid /  virion assembly / virion assembly /  ウイルスのライフサイクル / ウイルスのライフサイクル /  virion component ... virion component ... viral capsid, decoration / symbiont genome ejection through host cell envelope, long flexible tail mechanism / viral portal complex / viral tail assembly / viral DNA genome packaging / virus tail / T=7 icosahedral viral capsid / viral capsid, decoration / symbiont genome ejection through host cell envelope, long flexible tail mechanism / viral portal complex / viral tail assembly / viral DNA genome packaging / virus tail / T=7 icosahedral viral capsid /  virion assembly / virion assembly /  ウイルスのライフサイクル / ウイルスのライフサイクル /  virion component / virion component /  カプシド / host cell cytoplasm / structural molecule activity / カプシド / host cell cytoplasm / structural molecule activity /  DNA binding DNA binding類似検索 - 分子機能 | |||||||||
| 生物種 |   Escherichia phage Lambda (λファージ) Escherichia phage Lambda (λファージ) | |||||||||
| 手法 |  単粒子再構成法 / 単粒子再構成法 /  クライオ電子顕微鏡法 / 解像度: 4.07 Å クライオ電子顕微鏡法 / 解像度: 4.07 Å | |||||||||
 データ登録者 データ登録者 | Wang JW / Gu ZW | |||||||||
| 資金援助 |  中国, 2件 中国, 2件
| |||||||||
 引用 引用 |  ジャーナル: J Virol / 年: 2024 ジャーナル: J Virol / 年: 2024タイトル: Structural morphing in the viral portal vertex of bacteriophage lambda. 著者: Zhiwei Gu / Kexun Wu / Jiawei Wang /  要旨: The portal protein of tailed bacteriophage plays essential roles in various aspects of capsid assembly, motor assembly, genome packaging, connector formation, and infection processes. After DNA ...The portal protein of tailed bacteriophage plays essential roles in various aspects of capsid assembly, motor assembly, genome packaging, connector formation, and infection processes. After DNA packaging is complete, additional proteins are assembled onto the portal to form the connector complex, which is crucial as it bridges the mature head and tail. In this study, we report high-resolution cryo-electron microscopy (cryo-EM) structures of the portal vertex from bacteriophage lambda in both its prohead and mature virion states. Comparison of these structures shows that during head maturation, in addition to capsid expansion, the portal protein undergoes conformational changes to establish interactions with the connector proteins. Additionally, the independently assembled tail undergoes morphological alterations at its proximal end, facilitating its connection to the head-tail joining protein and resulting in the formation of a stable portal-connector-tail complex. The B-DNA molecule spirally glides through the tube, interacting with the nozzle blade region of the middle-ring connector protein. These insights elucidate a mechanism for portal maturation and DNA translocation within the phage lambda system. IMPORTANCE: The tailed bacteriophages possess a distinct portal vertex that consists of a ring of 12 portal proteins associated with a 5-fold capsid shell. This portal protein is crucial in multiple ...IMPORTANCE: The tailed bacteriophages possess a distinct portal vertex that consists of a ring of 12 portal proteins associated with a 5-fold capsid shell. This portal protein is crucial in multiple stages of virus assembly and infection. Our research focused on examining the structures of the portal vertex in both its preliminary prohead state and the fully mature virion state of bacteriophage lambda. By analyzing these structures, we were able to understand how the portal protein undergoes conformational changes during maturation, the mechanism by which it prevents DNA from escaping, and the process of DNA spirally gliding. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_38572.map.gz emd_38572.map.gz | 60.8 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-38572-v30.xml emd-38572-v30.xml emd-38572.xml emd-38572.xml | 19.3 KB 19.3 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_38572_fsc.xml emd_38572_fsc.xml | 10.6 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_38572.png emd_38572.png | 132.1 KB | ||
| Filedesc metadata |  emd-38572.cif.gz emd-38572.cif.gz | 5.9 KB | ||
| その他 |  emd_38572_half_map_1.map.gz emd_38572_half_map_1.map.gz emd_38572_half_map_2.map.gz emd_38572_half_map_2.map.gz | 116.1 MB 116.1 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-38572 http://ftp.pdbj.org/pub/emdb/structures/EMD-38572 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-38572 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-38572 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_38572.map.gz / 形式: CCP4 / 大きさ: 125 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_38572.map.gz / 形式: CCP4 / 大きさ: 125 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ボクセルのサイズ | X=Y=Z: 1.0742 Å | ||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
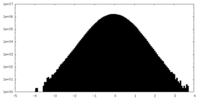
-ハーフマップ: #1
| ファイル | emd_38572_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
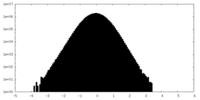
-ハーフマップ: #2
| ファイル | emd_38572_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : Escherichia phage Lambda
| 全体 | 名称:   Escherichia phage Lambda (λファージ) Escherichia phage Lambda (λファージ) |
|---|---|
| 要素 |
|
-超分子 #1: Escherichia phage Lambda
| 超分子 | 名称: Escherichia phage Lambda / タイプ: virus / ID: 1 / 親要素: 0 / 含まれる分子: all / NCBI-ID: 2681611 / 生物種: Escherichia phage Lambda / ウイルスタイプ: VIRION / ウイルス・単離状態: SEROCOMPLEX / ウイルス・エンベロープ: No / ウイルス・中空状態: No |
|---|
-分子 #1: Head-tail connector protein FII
| 分子 | 名称: Head-tail connector protein FII / タイプ: protein_or_peptide / ID: 1 / コピー数: 6 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:   Escherichia phage Lambda (λファージ) Escherichia phage Lambda (λファージ) |
| 分子量 | 理論値: 12.775037 KDa |
| 配列 | 文字列: MADFDNLFDA AIARADETIR GYMGTSATIT SGEQSGAVIR GVFDDPENIS YAGQGVRVEG SSPSLFVRTD EVRQLRRGDT LTIGEENFW VDRVSPDDGG SCHLWLGRGV PPAVNRRR UniProtKB: Head-tail connector protein FII |
-分子 #2: Head completion protein
| 分子 | 名称: Head completion protein / タイプ: protein_or_peptide / ID: 2 / コピー数: 12 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:   Escherichia phage Lambda (λファージ) Escherichia phage Lambda (λファージ) |
| 分子量 | 理論値: 7.625749 KDa |
| 配列 | 文字列: MTRQEELAAA RAALHDLMTG KRVATVQKDG RRVEFTATSV SDLKKYIAEL EVQTGMTQRR RGPAGFYV UniProtKB: Head completion protein |
-分子 #3: Tail tube terminator protein
| 分子 | 名称: Tail tube terminator protein / タイプ: protein_or_peptide / ID: 3 / コピー数: 6 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:   Escherichia phage Lambda (λファージ) Escherichia phage Lambda (λファージ) |
| 分子量 | 理論値: 14.659124 KDa |
| 配列 | 文字列: MKHTELRAAV LDALEKHDTG ATFFDGRPAV FDEADFPAVA VYLTGAEYTG EELDSDTWQA ELHIEVFLPA QVPDSELDAW MESRIYPVM SDIPALSDLI TSMVASGYDY RRDDDAGLWS SADLTYVITY EM UniProtKB: Tail tube terminator protein |
-分子 #4: Portal protein B
| 分子 | 名称: Portal protein B / タイプ: protein_or_peptide / ID: 4 / コピー数: 12 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:   Escherichia phage Lambda (λファージ) Escherichia phage Lambda (λファージ) |
| 分子量 | 理論値: 59.529609 KDa |
| 配列 | 文字列: MKTPTIPTLL GPDGMTSLRE YAGYHGGGSG FGGQLRSWNP PSESVDAALL PNFTRGNARA DDLVRNNGYA ANAIQLHQDH IVGSFFRLS HRPSWRYLGI GEEEARAFSR EVEAAWKEFA EDDCCCIDVE RKRTFTMMIR EGVAMHAFNG ELFVQATWDT S SSRLFRTQ ...文字列: MKTPTIPTLL GPDGMTSLRE YAGYHGGGSG FGGQLRSWNP PSESVDAALL PNFTRGNARA DDLVRNNGYA ANAIQLHQDH IVGSFFRLS HRPSWRYLGI GEEEARAFSR EVEAAWKEFA EDDCCCIDVE RKRTFTMMIR EGVAMHAFNG ELFVQATWDT S SSRLFRTQ FRMVSPKRIS NPNNTGDSRN CRAGVQINDS GAALGYYVSE DGYPGWMPQK WTWIPRELPG GRASFIHVFE PV EDGQTRG ANVFYSVMEQ MKMLDTLQNT QLQSAIVKAM YAATIESELD TQSAMDFILG ANSQEQRERL TGWIGEIAAY YAA APVRLG GAKVPHLMPG DSLNLQTAQD TDNGYSVFEQ SLLRYIAAGL GVSYEQLSRN YAQMSYSTAR ASANESWAYF MGRR KFVAS RQASQMFLCW LEEAIVRRVV TLPSKARFSF QEARSAWGNC DWIGSGRMAI DGLKEVQEAV MLIEAGLSTY EKECA KRGD DYQEIFAQQV RETMERRAAG LKPPAWAAAA FESGLRQSTE EEKSDSRAA UniProtKB: Portal protein B |
-分子 #5: Major capsid protein
| 分子 | 名称: Major capsid protein / タイプ: protein_or_peptide / ID: 5 / コピー数: 15 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:   Escherichia phage Lambda (λファージ) Escherichia phage Lambda (λファージ) |
| 分子量 | 理論値: 38.22916 KDa |
| 配列 | 文字列: MSMYTTAQLL AANEQKFKFD PLFLRLFFRE SYPFTTEKVY LSQIPGLVNM ALYVSPIVSG EVIRSRGGST SEFTPGYVKP KHEVNPQMT LRRLPDEDPQ NLADPAYRRR RIIMQNMRDE ELAIAQVEEM QAVSAVLKGK YTMTGEAFDP VEVDMGRSEE N NITQSGGT ...文字列: MSMYTTAQLL AANEQKFKFD PLFLRLFFRE SYPFTTEKVY LSQIPGLVNM ALYVSPIVSG EVIRSRGGST SEFTPGYVKP KHEVNPQMT LRRLPDEDPQ NLADPAYRRR RIIMQNMRDE ELAIAQVEEM QAVSAVLKGK YTMTGEAFDP VEVDMGRSEE N NITQSGGT EWSKRDKSTY DPTDDIEAYA LNASGVVNII VFDPKGWALF RSFKAVKEKL DTRRGSNSEL ETAVKDLGKA VS YKGMYGD VAIVVYSGQY VENGVKKNFL PDNTMVLGNT QARGLRTYGC IQDADAQREG INASARYPKN WVTTGDPARE FTM IQSAPL MLLADPDEFV SVQLA UniProtKB: Major capsid protein |
-分子 #6: Capsid decoration protein
| 分子 | 名称: Capsid decoration protein / タイプ: protein_or_peptide / ID: 6 / コピー数: 20 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:   Escherichia phage Lambda (λファージ) Escherichia phage Lambda (λファージ) |
| 分子量 | 理論値: 11.582873 KDa |
| 配列 | 文字列: MTSKETFTHY QPQGNSDPAH TATAPGGLSA KAPAMTPLML DTSSRKLVAW DGTTDGAAVG ILAVAADQTS TTLTFYKSGT FRYEDVLWP EAASDETKKR TAFAGTAISI V UniProtKB: Capsid decoration protein |
-実験情報
-構造解析
| 手法 |  クライオ電子顕微鏡法 クライオ電子顕微鏡法 |
|---|---|
 解析 解析 |  単粒子再構成法 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 緩衝液 | pH: 7 |
|---|---|
| 凍結 | 凍結剤: NITROGEN |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD Bright-field microscopy / 最大 デフォーカス(公称値): 2.0 µm / 最小 デフォーカス(公称値): 1.0 µm Bright-field microscopy / 最大 デフォーカス(公称値): 2.0 µm / 最小 デフォーカス(公称値): 1.0 µm |
| 撮影 | フィルム・検出器のモデル: GATAN K2 SUMMIT (4k x 4k) 平均電子線量: 50.0 e/Å2 |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
 ムービー
ムービー コントローラー
コントローラー













 Z
Z Y
Y X
X