登録情報 データベース : EMDB / ID : EMD-28487タイトル Eag Kv channel with voltage sensor in the up conformation 複合体 : Complex of Eag Kv channel bound to the inhibitor calmodulin-Ca2+タンパク質・ペプチド : Potassium voltage-gated channel subfamily H member 1タンパク質・ペプチド : Calmodulin-1機能・相同性 分子機能 ドメイン・相同性 構成要素
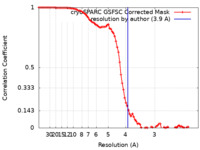
/ / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / 生物種 Rattus norvegicus (ドブネズミ) / Homo sapiens (ヒト)手法 / / 解像度 : 3.9 Å Mandala VS / MacKinnon R 資金援助 Organization Grant number 国 Howard Hughes Medical Institute (HHMI)
ジャーナル : Proc Natl Acad Sci U S A / 年 : 2022タイトル : Voltage-sensor movements in the Eag Kv channel under an applied electric field.著者 : Venkata Shiva Mandala / Roderick MacKinnon / 要旨 : Voltage-dependent ion channels regulate the opening of their pores by sensing the membrane voltage. This process underlies the propagation of action potentials and other forms of electrical activity ... Voltage-dependent ion channels regulate the opening of their pores by sensing the membrane voltage. This process underlies the propagation of action potentials and other forms of electrical activity in cells. The voltage dependence of these channels is governed by the transmembrane displacement of the positive charged S4 helix within their voltage-sensor domains. We use cryo-electron microscopy to visualize this movement in the mammalian Eag voltage-dependent potassium channel in lipid membrane vesicles with a voltage difference across the membrane. Multiple structural configurations show that the applied electric field displaces S4 toward the cytoplasm by two helical turns, resulting in an extended interfacial helix near the inner membrane leaflet. The position of S4 in this down conformation is sterically incompatible with an open pore, thus explaining how movement of the voltage sensor at hyperpolarizing membrane voltages locks the pore shut in this kind of voltage-dependent K (K) channel. The structures solved in lipid bilayer vesicles detail the intricate interplay between K channels and membranes, from showing how arginines are stabilized deep within the membrane and near phospholipid headgroups, to demonstrating how the channel reshapes the inner leaflet of the membrane itself. 履歴 登録 2022年10月4日 - ヘッダ(付随情報) 公開 2022年11月16日 - マップ公開 2022年11月16日 - 更新 2022年11月16日 - 現状 2022年11月16日 処理サイト : RCSB / 状態 : 公開
すべて表示 表示を減らす
 データを開く
データを開く 基本情報
基本情報
 マップデータ
マップデータ 試料
試料 機能・相同性情報
機能・相同性情報 potassium channel complex / regulation of presynaptic cytosolic calcium ion concentration / voltage-gated monoatomic ion channel activity involved in regulation of presynaptic membrane potential / delayed rectifier potassium channel activity /
potassium channel complex / regulation of presynaptic cytosolic calcium ion concentration / voltage-gated monoatomic ion channel activity involved in regulation of presynaptic membrane potential / delayed rectifier potassium channel activity /  CAM型光合成 / parallel fiber to Purkinje cell synapse / Cam-PDE 1 activation / Sodium/Calcium exchangers / nuclear inner membrane ...Voltage gated Potassium channels /
CAM型光合成 / parallel fiber to Purkinje cell synapse / Cam-PDE 1 activation / Sodium/Calcium exchangers / nuclear inner membrane ...Voltage gated Potassium channels /  potassium channel complex / regulation of presynaptic cytosolic calcium ion concentration / voltage-gated monoatomic ion channel activity involved in regulation of presynaptic membrane potential / delayed rectifier potassium channel activity /
potassium channel complex / regulation of presynaptic cytosolic calcium ion concentration / voltage-gated monoatomic ion channel activity involved in regulation of presynaptic membrane potential / delayed rectifier potassium channel activity /  CAM型光合成 / parallel fiber to Purkinje cell synapse / Cam-PDE 1 activation / Sodium/Calcium exchangers / nuclear inner membrane / Calmodulin induced events / Reduction of cytosolic Ca++ levels / CREB1 phosphorylation through the activation of CaMKII/CaMKK/CaMKIV cascasde / Activation of Ca-permeable Kainate Receptor / Loss of phosphorylation of MECP2 at T308 / CREB1 phosphorylation through the activation of Adenylate Cyclase / PKA activation /
CAM型光合成 / parallel fiber to Purkinje cell synapse / Cam-PDE 1 activation / Sodium/Calcium exchangers / nuclear inner membrane / Calmodulin induced events / Reduction of cytosolic Ca++ levels / CREB1 phosphorylation through the activation of CaMKII/CaMKK/CaMKIV cascasde / Activation of Ca-permeable Kainate Receptor / Loss of phosphorylation of MECP2 at T308 / CREB1 phosphorylation through the activation of Adenylate Cyclase / PKA activation /  phosphatidylinositol bisphosphate binding / negative regulation of high voltage-gated calcium channel activity / regulation of synaptic vesicle exocytosis / CaMK IV-mediated phosphorylation of CREB / Glycogen breakdown (glycogenolysis) / organelle localization by membrane tethering / negative regulation of calcium ion export across plasma membrane / Activation of RAC1 downstream of NMDARs / mitochondrion-endoplasmic reticulum membrane tethering / CLEC7A (Dectin-1) induces NFAT activation / regulation of cardiac muscle cell action potential / autophagosome membrane docking / positive regulation of ryanodine-sensitive calcium-release channel activity / regulation of cell communication by electrical coupling involved in cardiac conduction / Negative regulation of NMDA receptor-mediated neuronal transmission / negative regulation of peptidyl-threonine phosphorylation /
phosphatidylinositol bisphosphate binding / negative regulation of high voltage-gated calcium channel activity / regulation of synaptic vesicle exocytosis / CaMK IV-mediated phosphorylation of CREB / Glycogen breakdown (glycogenolysis) / organelle localization by membrane tethering / negative regulation of calcium ion export across plasma membrane / Activation of RAC1 downstream of NMDARs / mitochondrion-endoplasmic reticulum membrane tethering / CLEC7A (Dectin-1) induces NFAT activation / regulation of cardiac muscle cell action potential / autophagosome membrane docking / positive regulation of ryanodine-sensitive calcium-release channel activity / regulation of cell communication by electrical coupling involved in cardiac conduction / Negative regulation of NMDA receptor-mediated neuronal transmission / negative regulation of peptidyl-threonine phosphorylation /  startle response / Synthesis of IP3 and IP4 in the cytosol / Unblocking of NMDA receptors, glutamate binding and activation / Phase 0 - rapid depolarisation / protein phosphatase activator activity / RHO GTPases activate PAKs / positive regulation of cyclic-nucleotide phosphodiesterase activity / positive regulation of phosphoprotein phosphatase activity / Ion transport by P-type ATPases /
startle response / Synthesis of IP3 and IP4 in the cytosol / Unblocking of NMDA receptors, glutamate binding and activation / Phase 0 - rapid depolarisation / protein phosphatase activator activity / RHO GTPases activate PAKs / positive regulation of cyclic-nucleotide phosphodiesterase activity / positive regulation of phosphoprotein phosphatase activity / Ion transport by P-type ATPases /  長期増強 / Uptake and function of anthrax toxins / Regulation of MECP2 expression and activity / Calcineurin activates NFAT /
長期増強 / Uptake and function of anthrax toxins / Regulation of MECP2 expression and activity / Calcineurin activates NFAT /  catalytic complex / DARPP-32 events / detection of calcium ion /
catalytic complex / DARPP-32 events / detection of calcium ion /  axolemma / negative regulation of ryanodine-sensitive calcium-release channel activity / Smooth Muscle Contraction / RHO GTPases activate IQGAPs / regulation of cardiac muscle contraction / calcium channel inhibitor activity / cellular response to interferon-beta / regulation of cardiac muscle contraction by regulation of the release of sequestered calcium ion /
axolemma / negative regulation of ryanodine-sensitive calcium-release channel activity / Smooth Muscle Contraction / RHO GTPases activate IQGAPs / regulation of cardiac muscle contraction / calcium channel inhibitor activity / cellular response to interferon-beta / regulation of cardiac muscle contraction by regulation of the release of sequestered calcium ion /  Protein methylation / eNOS activation / Activation of AMPK downstream of NMDARs / regulation of release of sequestered calcium ion into cytosol by sarcoplasmic reticulum / regulation of calcium-mediated signaling / Tetrahydrobiopterin (BH4) synthesis, recycling, salvage and regulation / positive regulation of protein dephosphorylation / potassium ion transmembrane transport /
Protein methylation / eNOS activation / Activation of AMPK downstream of NMDARs / regulation of release of sequestered calcium ion into cytosol by sarcoplasmic reticulum / regulation of calcium-mediated signaling / Tetrahydrobiopterin (BH4) synthesis, recycling, salvage and regulation / positive regulation of protein dephosphorylation / potassium ion transmembrane transport /  voltage-gated potassium channel complex / Ion homeostasis / regulation of ryanodine-sensitive calcium-release channel activity /
voltage-gated potassium channel complex / Ion homeostasis / regulation of ryanodine-sensitive calcium-release channel activity /  titin binding / positive regulation of protein autophosphorylation / monoatomic ion transmembrane transport / sperm midpiece / 14-3-3 protein binding /
titin binding / positive regulation of protein autophosphorylation / monoatomic ion transmembrane transport / sperm midpiece / 14-3-3 protein binding /  calcium channel complex / substantia nigra development / cellular response to calcium ion / adenylate cyclase activator activity / Ras activation upon Ca2+ influx through NMDA receptor /
calcium channel complex / substantia nigra development / cellular response to calcium ion / adenylate cyclase activator activity / Ras activation upon Ca2+ influx through NMDA receptor /  regulation of heart rate /
regulation of heart rate /  sarcomere / protein serine/threonine kinase activator activity / FCERI mediated Ca+2 mobilization / FCGR3A-mediated IL10 synthesis / VEGFR2 mediated vascular permeability / positive regulation of peptidyl-threonine phosphorylation /
sarcomere / protein serine/threonine kinase activator activity / FCERI mediated Ca+2 mobilization / FCGR3A-mediated IL10 synthesis / VEGFR2 mediated vascular permeability / positive regulation of peptidyl-threonine phosphorylation /  regulation of cytokinesis / Antigen activates B Cell Receptor (BCR) leading to generation of second messengers / VEGFR2 mediated cell proliferation /
regulation of cytokinesis / Antigen activates B Cell Receptor (BCR) leading to generation of second messengers / VEGFR2 mediated cell proliferation /  regulation of membrane potential / Translocation of SLC2A4 (GLUT4) to the plasma membrane / postsynaptic density membrane / RAF activation / positive regulation of receptor signaling pathway via JAK-STAT / Transcriptional activation of mitochondrial biogenesis / positive regulation of protein serine/threonine kinase activity / spindle microtubule / Stimuli-sensing channels / cellular response to type II interferon /
regulation of membrane potential / Translocation of SLC2A4 (GLUT4) to the plasma membrane / postsynaptic density membrane / RAF activation / positive regulation of receptor signaling pathway via JAK-STAT / Transcriptional activation of mitochondrial biogenesis / positive regulation of protein serine/threonine kinase activity / spindle microtubule / Stimuli-sensing channels / cellular response to type II interferon /  紡錘体 / response to calcium ion
紡錘体 / response to calcium ion
 Rattus norvegicus (ドブネズミ) /
Rattus norvegicus (ドブネズミ) / 
 Homo sapiens (ヒト)
Homo sapiens (ヒト) 単粒子再構成法 /
単粒子再構成法 /  クライオ電子顕微鏡法 / 解像度: 3.9 Å
クライオ電子顕微鏡法 / 解像度: 3.9 Å  データ登録者
データ登録者 米国, 1件
米国, 1件  引用
引用 ジャーナル: Proc Natl Acad Sci U S A / 年: 2022
ジャーナル: Proc Natl Acad Sci U S A / 年: 2022
 構造の表示
構造の表示 ダウンロードとリンク
ダウンロードとリンク emd_28487.map.gz
emd_28487.map.gz EMDBマップデータ形式
EMDBマップデータ形式 emd-28487-v30.xml
emd-28487-v30.xml emd-28487.xml
emd-28487.xml EMDBヘッダ
EMDBヘッダ emd_28487_fsc.xml
emd_28487_fsc.xml FSCデータファイル
FSCデータファイル emd_28487.png
emd_28487.png emd_28487_additional_1.map.gz
emd_28487_additional_1.map.gz emd_28487_half_map_1.map.gz
emd_28487_half_map_1.map.gz emd_28487_half_map_2.map.gz
emd_28487_half_map_2.map.gz http://ftp.pdbj.org/pub/emdb/structures/EMD-28487
http://ftp.pdbj.org/pub/emdb/structures/EMD-28487 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-28487
ftp://ftp.pdbj.org/pub/emdb/structures/EMD-28487 リンク
リンク EMDB (EBI/PDBe) /
EMDB (EBI/PDBe) /  EMDataResource
EMDataResource マップ
マップ ダウンロード / ファイル: emd_28487.map.gz / 形式: CCP4 / 大きさ: 64 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES)
ダウンロード / ファイル: emd_28487.map.gz / 形式: CCP4 / 大きさ: 64 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) 試料の構成要素
試料の構成要素
 Rattus norvegicus (ドブネズミ)
Rattus norvegicus (ドブネズミ)
 Rattus norvegicus (ドブネズミ)
Rattus norvegicus (ドブネズミ)
 Homo sapiens (ヒト)
Homo sapiens (ヒト)
 Homo sapiens (ヒト)
Homo sapiens (ヒト)
 Homo sapiens (ヒト)
Homo sapiens (ヒト) クライオ電子顕微鏡法
クライオ電子顕微鏡法 解析
解析 単粒子再構成法
単粒子再構成法 試料調製
試料調製 電子顕微鏡法
電子顕微鏡法 FIELD EMISSION GUN
FIELD EMISSION GUN Bright-field microscopy / 最大 デフォーカス(公称値): 2.0 µm / 最小 デフォーカス(公称値): 1.0 µm
Bright-field microscopy / 最大 デフォーカス(公称値): 2.0 µm / 最小 デフォーカス(公称値): 1.0 µm
 ムービー
ムービー コントローラー
コントローラー




































 Z
Z Y
Y X
X