+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-10523 | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Cryo-EM structure of Toxoplasma gondii mitochondrial ATP synthase dimer, rotor-stator map | |||||||||||||||
 マップデータ マップデータ | Toxoplasma gondii ATP synthase dimer, rotor-stator full map | |||||||||||||||
 試料 試料 |
| |||||||||||||||
 キーワード キーワード |  mitochondrial (ミトコンドリア) / mitochondrial (ミトコンドリア) /  ATP synthase (ATP合成酵素) / rotor / ATP synthase (ATP合成酵素) / rotor /  stator (固定子) / stator (固定子) /  MEMBRANE PROTEIN (膜タンパク質) MEMBRANE PROTEIN (膜タンパク質) | |||||||||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報mitochondrial proton-transporting ATP synthase complex, coupling factor F(o) / mitochondrial proton-transporting ATP synthase complex, catalytic sector F(1) / chloroplast thylakoid membrane / proton motive force-driven mitochondrial ATP synthesis / proton motive force-driven ATP synthesis / proton transmembrane transporter activity / proton-transporting ATP synthase activity, rotational mechanism /  lipid binding / lipid binding /  生体膜 生体膜類似検索 - 分子機能 | |||||||||||||||
| 生物種 |   Toxoplasma gondii GT1 (トキソプラズマ) / Toxoplasma gondii GT1 (トキソプラズマ) /   Toxoplasma gondii (strain ATCC 50853 / GT1) (トキソプラズマ) Toxoplasma gondii (strain ATCC 50853 / GT1) (トキソプラズマ) | |||||||||||||||
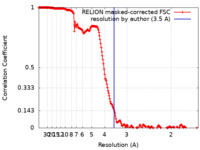
| 手法 |  単粒子再構成法 / 単粒子再構成法 /  クライオ電子顕微鏡法 / 解像度: 3.5 Å クライオ電子顕微鏡法 / 解像度: 3.5 Å | |||||||||||||||
 データ登録者 データ登録者 | Muhleip A / Kock Flygaard R / Amunts A | |||||||||||||||
| 資金援助 |  スウェーデン, 4件 スウェーデン, 4件
| |||||||||||||||
 引用 引用 |  ジャーナル: Nat Commun / 年: 2021 ジャーナル: Nat Commun / 年: 2021タイトル: ATP synthase hexamer assemblies shape cristae of Toxoplasma mitochondria. 著者: Alexander Mühleip / Rasmus Kock Flygaard / Jana Ovciarikova / Alice Lacombe / Paula Fernandes / Lilach Sheiner / Alexey Amunts /   要旨: Mitochondrial ATP synthase plays a key role in inducing membrane curvature to establish cristae. In Apicomplexa causing diseases such as malaria and toxoplasmosis, an unusual cristae morphology has ...Mitochondrial ATP synthase plays a key role in inducing membrane curvature to establish cristae. In Apicomplexa causing diseases such as malaria and toxoplasmosis, an unusual cristae morphology has been observed, but its structural basis is unknown. Here, we report that the apicomplexan ATP synthase assembles into cyclic hexamers, essential to shape their distinct cristae. Cryo-EM was used to determine the structure of the hexamer, which is held together by interactions between parasite-specific subunits in the lumenal region. Overall, we identified 17 apicomplexan-specific subunits, and a minimal and nuclear-encoded subunit-a. The hexamer consists of three dimers with an extensive dimer interface that includes bound cardiolipins and the inhibitor IF. Cryo-ET and subtomogram averaging revealed that hexamers arrange into ~20-megadalton pentagonal pyramids in the curved apical membrane regions. Knockout of the linker protein ATPTG11 resulted in the loss of pentagonal pyramids with concomitant aberrantly shaped cristae. Together, this demonstrates that the unique macromolecular arrangement is critical for the maintenance of cristae morphology in Apicomplexa. | |||||||||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_10523.map.gz emd_10523.map.gz | 378 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-10523-v30.xml emd-10523-v30.xml emd-10523.xml emd-10523.xml | 21.6 KB 21.6 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_10523_fsc.xml emd_10523_fsc.xml | 19.9 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_10523.png emd_10523.png | 39 KB | ||
| マスクデータ |  emd_10523_msk_1.map emd_10523_msk_1.map | 669.9 MB |  マスクマップ マスクマップ | |
| Filedesc metadata |  emd-10523.cif.gz emd-10523.cif.gz | 6.2 KB | ||
| その他 |  emd_10523_half_map_1.map.gz emd_10523_half_map_1.map.gz emd_10523_half_map_2.map.gz emd_10523_half_map_2.map.gz | 538.6 MB 538.8 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-10523 http://ftp.pdbj.org/pub/emdb/structures/EMD-10523 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-10523 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-10523 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_10523.map.gz / 形式: CCP4 / 大きさ: 669.9 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_10523.map.gz / 形式: CCP4 / 大きさ: 669.9 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Toxoplasma gondii ATP synthase dimer, rotor-stator full map | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 0.83 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
-マスク #1
| ファイル |  emd_10523_msk_1.map emd_10523_msk_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
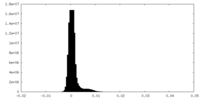
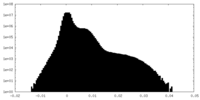
| 密度ヒストグラム |
-ハーフマップ: Halfmap 2
| ファイル | emd_10523_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Halfmap 2 | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: Halfmap 1
| ファイル | emd_10523_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Halfmap 1 | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : Mitochondrial ATP synthase dimer, rotor-stator
| 全体 | 名称: Mitochondrial ATP synthase dimer, rotor-stator |
|---|---|
| 要素 |
|
-超分子 #1: Mitochondrial ATP synthase dimer, rotor-stator
| 超分子 | 名称: Mitochondrial ATP synthase dimer, rotor-stator / タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: all |
|---|---|
| 由来(天然) | 生物種:   Toxoplasma gondii GT1 (トキソプラズマ) Toxoplasma gondii GT1 (トキソプラズマ) |
| 分子量 | 理論値: 127 KDa |
-分子 #1: ATPTG11
| 分子 | 名称: ATPTG11 / タイプ: protein_or_peptide / ID: 1 / コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:   Toxoplasma gondii (strain ATCC 50853 / GT1) (トキソプラズマ) Toxoplasma gondii (strain ATCC 50853 / GT1) (トキソプラズマ)株: ATCC 50853 / GT1 |
| 分子量 | 理論値: 15.425367 KDa |
| 配列 | 文字列: MVRNQRYPAS PVQEIFLPEP VPFVQFDQTA PSPNSPPAPL PSPSLSQCEE QKDRYRDISS MFHRGVAGAE QVREAYNSMA KCFRRVSVA EVLESDPAFR QARNFTMDLK QAEDDQRYKQ LQYGRVPSIL TKYHL UniProtKB: Uncharacterized protein |
-分子 #2: subunit a
| 分子 | 名称: subunit a / タイプ: protein_or_peptide / ID: 2 / コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:   Toxoplasma gondii (strain ATCC 50853 / GT1) (トキソプラズマ) Toxoplasma gondii (strain ATCC 50853 / GT1) (トキソプラズマ)株: ATCC 50853 / GT1 |
| 分子量 | 理論値: 24.56257 KDa |
| 配列 | 文字列: MAAGSRFPFC TAARLSSRGT LPRLGEATFF AGAESQRSAG AFAKTLQRPF LRAPSTQLFP VGNRLGVSSA RALVANAMEP RRFFAAAAS AKATHALQPT GTGSVAFTRP GQGSNAQFQT SLADKTRGLL GVGFLRPTKM ASFAATFLLN FRFYFMYMAR T TFQAVRPL ...文字列: MAAGSRFPFC TAARLSSRGT LPRLGEATFF AGAESQRSAG AFAKTLQRPF LRAPSTQLFP VGNRLGVSSA RALVANAMEP RRFFAAAAS AKATHALQPT GTGSVAFTRP GQGSNAQFQT SLADKTRGLL GVGFLRPTKM ASFAATFLLN FRFYFMYMAR T TFQAVRPL LAFSVFGEVM KLVLATMSSG LFSFLFSFVL AFEVFYFFLQ CYISYTFLTM FFTVLF UniProtKB:  膜貫通型タンパク質 膜貫通型タンパク質 |
-分子 #3: ATP synthase subunit gamma
| 分子 | 名称: ATP synthase subunit gamma / タイプ: protein_or_peptide / ID: 3 / コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:   Toxoplasma gondii (strain ATCC 50853 / GT1) (トキソプラズマ) Toxoplasma gondii (strain ATCC 50853 / GT1) (トキソプラズマ)株: ATCC 50853 / GT1 |
| 分子量 | 理論値: 34.573031 KDa |
| 配列 | 文字列: MAGLASLSSV GALRGMRLVP AAHLLPLHSA FGQQTRNFGA GDLKIVAARM KSVKSIQKIT KAMKMVAASK LRMDQRRLEN GLPFATPVQ KLVQRIPVDP KEKGTLAVLA LSSDKGLCGG VNSFVAKQAR IVIKENEMAG NAVQVYGVGD KIRSALQRTF G DRFKRIMT ...文字列: MAGLASLSSV GALRGMRLVP AAHLLPLHSA FGQQTRNFGA GDLKIVAARM KSVKSIQKIT KAMKMVAASK LRMDQRRLEN GLPFATPVQ KLVQRIPVDP KEKGTLAVLA LSSDKGLCGG VNSFVAKQAR IVIKENEMAG NAVQVYGVGD KIRSALQRTF G DRFKRIMT EVTRFPWNFG QACIIADRLM QDNPARLMVI YNHFKSAVAY DTLTLNVLTP TQAAQSAKEQ LNTFEFEPEK TD VWKDLQD FYYACTVFGC MLDNIASEQS ARMSAMDNAS TNAGEMISSL TLRYNRARQA KITTELVEII SGANALE UniProtKB:  ATP synthase subunit gamma, mitochondrial ATP synthase subunit gamma, mitochondrial |
-分子 #4: ATP synthase subunit delta
| 分子 | 名称: ATP synthase subunit delta / タイプ: protein_or_peptide / ID: 4 / コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:   Toxoplasma gondii (strain ATCC 50853 / GT1) (トキソプラズマ) Toxoplasma gondii (strain ATCC 50853 / GT1) (トキソプラズマ)株: ATCC 50853 / GT1 |
| 分子量 | 理論値: 19.476082 KDa |
| 配列 | 文字列: MFARAFSRFA SLAAPAPQRG WNAFVLPSRH FATAAGGANP FKNQLLLTLS SPSEAIYVRT PVRSVTVPGS EGAMTMTNGH SQTVARLKA GEIIVRKGET GDEVERFFLS DGFVLFKSPE DDSGCCTAEV LGVEVVPVSM LDKESAATAL QELLQQGAGA T DEWTKART LLGQELLSSV IRAAP UniProtKB:  Putative ATP synthase Putative ATP synthase |
-分子 #5: ATP synthase subunit epsilon
| 分子 | 名称: ATP synthase subunit epsilon / タイプ: protein_or_peptide / ID: 5 / コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:   Toxoplasma gondii (strain ATCC 50853 / GT1) (トキソプラズマ) Toxoplasma gondii (strain ATCC 50853 / GT1) (トキソプラズマ)株: ATCC 50853 / GT1 |
| 分子量 | 理論値: 8.492709 KDa |
| 配列 | 文字列: MWRSSGVSFT RYASEMAALL RQCLKEPYRT QAMQRNQIHL KETVYQQGQV LTRETFNDIK KAFEAAAKHA GEK UniProtKB: Putative atp synthase F1, epsilon subunit |
-分子 #6: subunit c
| 分子 | 名称: subunit c / タイプ: protein_or_peptide / ID: 6 / コピー数: 10 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:   Toxoplasma gondii (strain ATCC 50853 / GT1) (トキソプラズマ) Toxoplasma gondii (strain ATCC 50853 / GT1) (トキソプラズマ)株: ATCC 50853 / GT1 |
| 分子量 | 理論値: 17.753504 KDa |
| 配列 | 文字列: MFFSRLSLSA LKAAPAREAL PGLLSRQSFS SAGFSQFSSQ KFFFSPSRNF SQSPLFQKHT PVHCNQRIAS ALVPTQQPAM TRQNPYAMQ VGARYDAGVA SLSAAIALMS VGGVAQGIGS LFAALVSGTA RNPSIKEDLF TYTLIGMGFL EFLGIICVLM S AVLLYS UniProtKB: Putative ATP synthase F0 subunit 9 |
-実験情報
-構造解析
| 手法 |  クライオ電子顕微鏡法 クライオ電子顕微鏡法 |
|---|---|
 解析 解析 |  単粒子再構成法 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 5 mg/mL |
|---|---|
| 緩衝液 | pH: 7.5 |
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 100 % / 装置: FEI VITROBOT MARK IV / 詳細: 3 seconds blot.. |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD Bright-field microscopy / Cs: 2.7 mm / 倍率(公称値): 165000 Bright-field microscopy / Cs: 2.7 mm / 倍率(公称値): 165000 |
| 特殊光学系 | エネルギーフィルター - 名称: GIF Quantum LS / エネルギーフィルター - スリット幅: 20 eV |
| 試料ステージ | 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER ホルダー冷却材: NITROGEN |
| 撮影 | フィルム・検出器のモデル: GATAN K2 QUANTUM (4k x 4k) 検出モード: COUNTING / 実像数: 4860 / 平均電子線量: 30.0 e/Å2 |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
- 画像解析
画像解析
-原子モデル構築 1
| 精密化 | 空間: REAL |
|---|---|
| 得られたモデル |  PDB-6tmj: |
 ムービー
ムービー コントローラー
コントローラー

























 Z
Z Y
Y X
X