+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-8946 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Mitochondrial peroxiredoxin from Leishmania infantum in complex with unfolding client protein after heat stress | |||||||||
 マップデータ マップデータ | structure of mitochondrial peroxiredoxin from Leishmania infantum adopting chaperone function in complex with unfolding client protein | |||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | heat-shock / client-binding /  holdase / unfolding / holdase / unfolding /  CHAPERONE (シャペロン) CHAPERONE (シャペロン) | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報 | |||||||||
| 生物種 |   Leishmania infantum (幼児リーシュマニア) Leishmania infantum (幼児リーシュマニア) | |||||||||
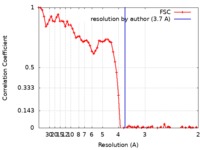
| 手法 |  単粒子再構成法 / 単粒子再構成法 /  クライオ電子顕微鏡法 / 解像度: 3.7 Å クライオ電子顕微鏡法 / 解像度: 3.7 Å | |||||||||
 データ登録者 データ登録者 | Teixeira F / Tse E | |||||||||
 引用 引用 |  ジャーナル: Nat Commun / 年: 2019 ジャーナル: Nat Commun / 年: 2019タイトル: Chaperone activation and client binding of a 2-cysteine peroxiredoxin. 著者: Filipa Teixeira / Eric Tse / Helena Castro / Karl A T Makepeace / Ben A Meinen / Christoph H Borchers / Leslie B Poole / James C Bardwell / Ana M Tomás / Daniel R Southworth / Ursula Jakob /    要旨: Many 2-Cys-peroxiredoxins (2-Cys-Prxs) are dual-function proteins, either acting as peroxidases under non-stress conditions or as chaperones during stress. The mechanism by which 2-Cys-Prxs switch ...Many 2-Cys-peroxiredoxins (2-Cys-Prxs) are dual-function proteins, either acting as peroxidases under non-stress conditions or as chaperones during stress. The mechanism by which 2-Cys-Prxs switch functions remains to be defined. Our work focuses on Leishmania infantum mitochondrial 2-Cys-Prx, whose reduced, decameric subpopulation adopts chaperone function during heat shock, an activity that facilitates the transition from insects to warm-blooded host environments. Here, we have solved the cryo-EM structure of mTXNPx in complex with a thermally unfolded client protein, and revealed that the flexible N-termini of mTXNPx form a well-resolved central belt that contacts and encapsulates the unstructured client protein in the center of the decamer ring. In vivo and in vitro cross-linking studies provide further support for these interactions, and demonstrate that mTXNPx decamers undergo temperature-dependent structural rearrangements specifically at the dimer-dimer interfaces. These structural changes appear crucial for exposing chaperone-client binding sites that are buried in the peroxidase-active protein. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_8946.map.gz emd_8946.map.gz | 17.2 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-8946-v30.xml emd-8946-v30.xml emd-8946.xml emd-8946.xml | 10.8 KB 10.8 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_8946_fsc.xml emd_8946_fsc.xml | 7.5 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_8946.png emd_8946.png | 279 KB | ||
| Filedesc metadata |  emd-8946.cif.gz emd-8946.cif.gz | 5.2 KB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-8946 http://ftp.pdbj.org/pub/emdb/structures/EMD-8946 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-8946 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-8946 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_8946.map.gz / 形式: CCP4 / 大きさ: 22.2 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_8946.map.gz / 形式: CCP4 / 大きさ: 22.2 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | structure of mitochondrial peroxiredoxin from Leishmania infantum adopting chaperone function in complex with unfolding client protein | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
- 試料の構成要素
試料の構成要素
-全体 : Chaperone complex of a 2-cys peroxiredoxin binding to unfolded cl...
| 全体 | 名称: Chaperone complex of a 2-cys peroxiredoxin binding to unfolded client protein luciferase after heat stress |
|---|---|
| 要素 |
|
-超分子 #1: Chaperone complex of a 2-cys peroxiredoxin binding to unfolded cl...
| 超分子 | 名称: Chaperone complex of a 2-cys peroxiredoxin binding to unfolded client protein luciferase after heat stress タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: all |
|---|---|
| 由来(天然) | 生物種:   Leishmania infantum (幼児リーシュマニア) Leishmania infantum (幼児リーシュマニア) |
-分子 #1: mitochondrial 2-cys-peroxiredoxin
| 分子 | 名称: mitochondrial 2-cys-peroxiredoxin / タイプ: protein_or_peptide / ID: 1 / コピー数: 10 / 光学異性体: LEVO EC番号:  酸化還元酵素; 過酸化物を電子受容体にする; ペルオキシダーゼ 酸化還元酵素; 過酸化物を電子受容体にする; ペルオキシダーゼ |
|---|---|
| 由来(天然) | 生物種:   Leishmania infantum (幼児リーシュマニア) Leishmania infantum (幼児リーシュマニア) |
| 分子量 | 理論値: 25.400131 KDa |
| 組換発現 | 生物種:   Escherichia coli (大腸菌) Escherichia coli (大腸菌) |
| 配列 | 文字列: MLRRLPTSCF LKRSQFRGFA ATSPLLNLDY QMYRTATVRE AAPQFSGQAV VNGAIKDINM NDYKGKYIVL FFYPMDFTFV CPTEIIAFS DRHADFEKLN TQVVAVSCDS VYSHLAWVNT PRKKGGLGEM HIPVLADKSM EIARDYGVLI EESGIALRGL F IIDKKGIL ...文字列: MLRRLPTSCF LKRSQFRGFA ATSPLLNLDY QMYRTATVRE AAPQFSGQAV VNGAIKDINM NDYKGKYIVL FFYPMDFTFV CPTEIIAFS DRHADFEKLN TQVVAVSCDS VYSHLAWVNT PRKKGGLGEM HIPVLADKSM EIARDYGVLI EESGIALRGL F IIDKKGIL RHSTINDLPV GRNVDEALRV LEAFQYADEN GDAIPCGWKP GQPTLDTTKA GEFFEKNM UniProtKB: thioredoxin-dependent peroxiredoxin |
-実験情報
-構造解析
| 手法 |  クライオ電子顕微鏡法 クライオ電子顕微鏡法 |
|---|---|
 解析 解析 |  単粒子再構成法 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 0.2 mg/mL |
|---|---|
| 緩衝液 | pH: 8 |
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 100 % / 装置: FEI VITROBOT MARK IV |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD Bright-field microscopy / 最大 デフォーカス(公称値): 2.7 µm / 最小 デフォーカス(公称値): 1.6 µm / 倍率(公称値): 50000 Bright-field microscopy / 最大 デフォーカス(公称値): 2.7 µm / 最小 デフォーカス(公称値): 1.6 µm / 倍率(公称値): 50000 |
| 試料ステージ | 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER ホルダー冷却材: NITROGEN |
| 撮影 | フィルム・検出器のモデル: GATAN K2 SUMMIT (4k x 4k) 検出モード: COUNTING / デジタル化 - サイズ - 横: 3838 pixel / デジタル化 - サイズ - 縦: 3710 pixel / 実像数: 2810 / 平均電子線量: 45.0 e/Å2 |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
 ムービー
ムービー コントローラー
コントローラー














 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)