+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Cryo-EM structure of Karyopherin-beta2 bound to HNRNPH2 PY-NLS | |||||||||||||||
 マップデータ マップデータ | ||||||||||||||||
 試料 試料 |
| |||||||||||||||
 キーワード キーワード | RNA-binding protein TNPO1 Cryo-EM KapB2 HNRNP /  TRANSPORT PROTEIN (運搬体タンパク質) TRANSPORT PROTEIN (運搬体タンパク質) | |||||||||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報Tristetraprolin (TTP, ZFP36) binds and destabilizes mRNA /  Intraflagellar transport / Postmitotic nuclear pore complex (NPC) reformation / nuclear import signal receptor activity / Intraflagellar transport / Postmitotic nuclear pore complex (NPC) reformation / nuclear import signal receptor activity /  nuclear localization sequence binding / nuclear localization sequence binding /  regulation of RNA splicing / Processing of Capped Intron-Containing Pre-mRNA / mRNA Splicing - Major Pathway / regulation of RNA splicing / Processing of Capped Intron-Containing Pre-mRNA / mRNA Splicing - Major Pathway /  繊毛 / 繊毛 /  small GTPase binding ...Tristetraprolin (TTP, ZFP36) binds and destabilizes mRNA / small GTPase binding ...Tristetraprolin (TTP, ZFP36) binds and destabilizes mRNA /  Intraflagellar transport / Postmitotic nuclear pore complex (NPC) reformation / nuclear import signal receptor activity / Intraflagellar transport / Postmitotic nuclear pore complex (NPC) reformation / nuclear import signal receptor activity /  nuclear localization sequence binding / nuclear localization sequence binding /  regulation of RNA splicing / Processing of Capped Intron-Containing Pre-mRNA / mRNA Splicing - Major Pathway / regulation of RNA splicing / Processing of Capped Intron-Containing Pre-mRNA / mRNA Splicing - Major Pathway /  繊毛 / 繊毛 /  small GTPase binding / protein import into nucleus / small GTPase binding / protein import into nucleus /  postsynaptic density / postsynaptic density /  ribonucleoprotein complex / ribonucleoprotein complex /  RNA binding / extracellular exosome / RNA binding / extracellular exosome /  核質 / 核質 /  生体膜 / 生体膜 /  細胞核 / 細胞核 /  細胞質基質 / 細胞質基質 /  細胞質 細胞質類似検索 - 分子機能 | |||||||||||||||
| 生物種 |   Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||||||||
| 手法 |  単粒子再構成法 / 単粒子再構成法 /  クライオ電子顕微鏡法 / 解像度: 3.17 Å クライオ電子顕微鏡法 / 解像度: 3.17 Å | |||||||||||||||
 データ登録者 データ登録者 | Gonzalez A / Fung HYJ / Chook YM | |||||||||||||||
| 資金援助 |  米国, 4件 米国, 4件
| |||||||||||||||
 引用 引用 |  ジャーナル: Structure / 年: 2023 ジャーナル: Structure / 年: 2023タイトル: A new Karyopherin-β2 binding PY-NLS epitope of HNRNPH2 linked to neurodevelopmental disorders. 著者: Abner Gonzalez / Hong Joo Kim / Brian D Freibaum / Ho Yee Joyce Fung / Chad A Brautigam / J Paul Taylor / Yuh Min Chook /  要旨: The HNRNPH2 proline-tyrosine nuclear localization signal (PY-NLS) is mutated in HNRNPH2-related X-linked neurodevelopmental disorder, causing the normally nuclear HNRNPH2 to accumulate in the ...The HNRNPH2 proline-tyrosine nuclear localization signal (PY-NLS) is mutated in HNRNPH2-related X-linked neurodevelopmental disorder, causing the normally nuclear HNRNPH2 to accumulate in the cytoplasm. We solved the cryoelectron microscopy (cryo-EM) structure of Karyopherin-β2/Transportin-1 bound to the HNRNPH2 PY-NLS to understand importin-NLS recognition and disruption in disease. HNRNPH2 RPGPY is a typical R-X-P-Y motif comprising PY-NLS epitopes 2 and 3, followed by an additional Karyopherin-β2-binding epitope, we term epitope 4, at residues DRP; no density is present for PY-NLS epitope 1. Disease variant mutations at epitopes 2-4 impair Karyopherin-β2 binding and cause aberrant cytoplasmic accumulation in cells, emphasizing the role of nuclear import defect in disease. Sequence/structure analysis suggests that strong PY-NLS epitopes 4 are rare and thus far limited to close paralogs of HNRNPH2, HNRNPH1, and HNRNPF. Epitope 4-binidng hotspot Karyopherin-β2 W373 corresponds to close paralog Karyopherin-β2b/Transportin-2 W370, a pathological variant site in neurodevelopmental abnormalities, suggesting that Karyopherin-β2b/Transportin-2-HNRNPH2/H1/F interactions may be compromised in the abnormalities. | |||||||||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_40455.map.gz emd_40455.map.gz | 403.8 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-40455-v30.xml emd-40455-v30.xml emd-40455.xml emd-40455.xml | 18.2 KB 18.2 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  emd_40455.png emd_40455.png | 53 KB | ||
| その他 |  emd_40455_half_map_1.map.gz emd_40455_half_map_1.map.gz emd_40455_half_map_2.map.gz emd_40455_half_map_2.map.gz | 764 MB 764 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-40455 http://ftp.pdbj.org/pub/emdb/structures/EMD-40455 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-40455 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-40455 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  8sghMC M: このマップから作成された原子モデル C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_40455.map.gz / 形式: CCP4 / 大きさ: 824 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_40455.map.gz / 形式: CCP4 / 大きさ: 824 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ボクセルのサイズ | X=Y=Z: 0.415 Å | ||||||||||||||||||||
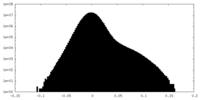
| 密度 |
| ||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-ハーフマップ: #2
| ファイル | emd_40455_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
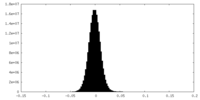
| 密度ヒストグラム |
-ハーフマップ: #1
| ファイル | emd_40455_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
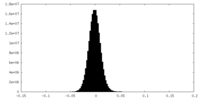
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : Karyopherin-beta2 bound to hnRNP H2 PY-NLS
| 全体 | 名称: Karyopherin-beta2 bound to hnRNP H2 PY-NLS |
|---|---|
| 要素 |
|
-超分子 #1: Karyopherin-beta2 bound to hnRNP H2 PY-NLS
| 超分子 | 名称: Karyopherin-beta2 bound to hnRNP H2 PY-NLS / タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: all |
|---|---|
| 由来(天然) | 生物種:   Homo sapiens (ヒト) Homo sapiens (ヒト) |
-分子 #1: Transportin-1
| 分子 | 名称: Transportin-1 / タイプ: protein_or_peptide / ID: 1 / コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:   Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 101.738812 KDa |
| 組換発現 | 生物種:   Escherichia coli BL21(DE3) (大腸菌) Escherichia coli BL21(DE3) (大腸菌) |
| 配列 | 文字列: GGSKMEYEWK PDEQGLQQIL QLLKESQSPD TTIQRTVQQK LEQLNQYPDF NNYLIFVLTK LKSEDEPTRS LSGLILKNNV KAHFQNFPN GVTDFIKSEC LNNIGDSSPL IRATVGILIT TIASKGELQN WPDLLPKLCS LLDSEDYNTC EGAFGALQKI C EDSAEILD ...文字列: GGSKMEYEWK PDEQGLQQIL QLLKESQSPD TTIQRTVQQK LEQLNQYPDF NNYLIFVLTK LKSEDEPTRS LSGLILKNNV KAHFQNFPN GVTDFIKSEC LNNIGDSSPL IRATVGILIT TIASKGELQN WPDLLPKLCS LLDSEDYNTC EGAFGALQKI C EDSAEILD SDVLDRPLNI MIPKFLQFFK HSSPKIRSHA VACVNQFIIS RTQALMLHID SFIENLFALA GDEEPEVRKN VC RALVMLL EVRMDRLLPH MHNIVEYMLQ RTQDQDENVA LEACEFWLTL AEQPICKDVL VRHLPKLIPV LVNGMKYSDI DII LLKGDV EEDETIPDSE QDIRPRFHRS RTVAQQHDED GIEEEDDDDD EIDDDDTISD WNLRKCSAAA LDVLANVYRD ELLP HILPL LKELLFHHEW VVKESGILVL GAIAEGCMQG MIPYLPELIP HLIQCLSDKK ALVRSITCWT LSRYAHWVVS QPPDT YLKP LMTELLKRIL DSNKRVQEAA CSAFATLEEE ACTELVPYLA YILDTLVFAF SKYQHKNLLI LYDAIGTLAD SVGHHL NKP EYIQMLMPPL IQKWNMLKDE DKDLFPLLEC LSSVATALQS GFLPYCEPVY QRCVNLVQKT LAQAMLNNAQ PDQYEAP DK DFMIVALDLL SGLAEGLGGN IEQLVARSNI LTLMYQCMQD KMPEVRQSSF ALLGDLTKAC FQHVKPCIAD FMPILGTN L NPEFISVCNN ATWAIGEISI QMGIEMQPYI PMVLHQLVEI INRPNTPKTL LENTAITIGR LGYVCPQEVA PMLQQFIRP WCTSLRNIRD NEEKDSAFRG ICTMISVNPS GVIQDFIFFC DAVASWINPK DDLRDMFCKI LHGFKNQVGD ENWRRFSDQF PLPLKERLA AFYGV UniProtKB: Transportin-1 |
-分子 #2: Heterogeneous nuclear ribonucleoprotein H2, N-terminally processed
| 分子 | 名称: Heterogeneous nuclear ribonucleoprotein H2, N-terminally processed タイプ: protein_or_peptide / ID: 2 / コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:   Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 13.993811 KDa |
| 組換発現 | 生物種:   Escherichia coli BL21(DE3) (大腸菌) Escherichia coli BL21(DE3) (大腸菌) |
| 配列 | 文字列: GGSNSPDTAN DGFVRLRGLP FGCSKEEIVQ FFSGLEIVPN GMTLPVDFQG RSTGEAFVQF ASQEIAEKAL KKHKERIGHR YIEIFKSSR AEVRTHYDPP RKLMAMQRPG PYDRPGAGRG YNSIGRG UniProtKB: Heterogeneous nuclear ribonucleoprotein H2 |
-実験情報
-構造解析
| 手法 |  クライオ電子顕微鏡法 クライオ電子顕微鏡法 |
|---|---|
 解析 解析 |  単粒子再構成法 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 2.7 mg/mL |
|---|---|
| 緩衝液 | pH: 7.5 詳細: 20 mM Tris-HCl pH 7.5, 150 nM NaCl, 2 mM BME, 0.003125% [w/v] NP-40 |
| グリッド | モデル: Quantifoil R1.2/1.3 / 材質: COPPER / メッシュ: 300 / 支持フィルム - 材質: CARBON / 前処理 - タイプ: GLOW DISCHARGE |
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 95 % / チャンバー内温度: 277.15 K |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD Bright-field microscopy / 最大 デフォーカス(公称値): 2.2 µm / 最小 デフォーカス(公称値): 1.0 µm Bright-field microscopy / 最大 デフォーカス(公称値): 2.2 µm / 最小 デフォーカス(公称値): 1.0 µm |
| 特殊光学系 | エネルギーフィルター - スリット幅: 20 eV |
| 撮影 | フィルム・検出器のモデル: GATAN K3 (6k x 4k) / 平均電子線量: 60.0 e/Å2 |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
- 画像解析
画像解析
| 初期モデル | モデルのタイプ: OTHER |
|---|---|
| 初期 角度割当 | タイプ: MAXIMUM LIKELIHOOD / ソフトウェア - 名称: cryoSPARC |
| 最終 3次元分類 | クラス数: 7 / ソフトウェア - 名称: cryoSPARC |
| 最終 角度割当 | タイプ: MAXIMUM LIKELIHOOD / ソフトウェア - 名称: cryoSPARC |
| 最終 再構成 | 使用したクラス数: 1 / 想定した対称性 - 点群: C1 (非対称) / 解像度のタイプ: BY AUTHOR / 解像度: 3.17 Å / 解像度の算出法: FSC 0.143 CUT-OFF / ソフトウェア - 名称: cryoSPARC / 詳細: Non-uniform refinement / 使用した粒子像数: 208572 |
-原子モデル構築 1
| 詳細 | Initial docking performed using Chimera, then manual model building by Coot, ISOLDE in ChimerX and Phenix real-space refinement. |
|---|---|
| 得られたモデル |  PDB-8sgh: |
 ムービー
ムービー コントローラー
コントローラー









 Z
Z Y
Y X
X