+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Structure of the leucine-rich repeat kinase 1 monomer | |||||||||
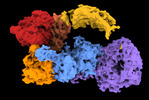
 マップデータ マップデータ | Composite map used for refinement | |||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード |  kinase (キナーゼ) / LRRK / kinase (キナーゼ) / LRRK /  multi-domain protein (タンパク質ドメイン) / multi-domain protein (タンパク質ドメイン) /  GTPase (GTPアーゼ) / GTPase (GTPアーゼ) /  TRANSFERASE (転移酵素) TRANSFERASE (転移酵素) | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報negative regulation of peptidyl-tyrosine phosphorylation / osteoclast development / positive regulation of intracellular signal transduction /  bone resorption / positive regulation of peptidyl-tyrosine phosphorylation / positive regulation of canonical Wnt signaling pathway / bone resorption / positive regulation of peptidyl-tyrosine phosphorylation / positive regulation of canonical Wnt signaling pathway /  non-specific serine/threonine protein kinase / intracellular signal transduction / non-specific serine/threonine protein kinase / intracellular signal transduction /  リン酸化 / protein serine kinase activity ...negative regulation of peptidyl-tyrosine phosphorylation / osteoclast development / positive regulation of intracellular signal transduction / リン酸化 / protein serine kinase activity ...negative regulation of peptidyl-tyrosine phosphorylation / osteoclast development / positive regulation of intracellular signal transduction /  bone resorption / positive regulation of peptidyl-tyrosine phosphorylation / positive regulation of canonical Wnt signaling pathway / bone resorption / positive regulation of peptidyl-tyrosine phosphorylation / positive regulation of canonical Wnt signaling pathway /  non-specific serine/threonine protein kinase / intracellular signal transduction / non-specific serine/threonine protein kinase / intracellular signal transduction /  リン酸化 / protein serine kinase activity / protein serine/threonine kinase activity / GTP binding / リン酸化 / protein serine kinase activity / protein serine/threonine kinase activity / GTP binding /  ミトコンドリア / ミトコンドリア /  ATP binding / identical protein binding / ATP binding / identical protein binding /  metal ion binding / metal ion binding /  細胞質基質 細胞質基質類似検索 - 分子機能 | |||||||||
| 生物種 |   Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||
| 手法 |  単粒子再構成法 / 単粒子再構成法 /  クライオ電子顕微鏡法 / 解像度: 3.92 Å クライオ電子顕微鏡法 / 解像度: 3.92 Å | |||||||||
 データ登録者 データ登録者 | Metcalfe RD / Martinez Fiesco JA / Zhang P | |||||||||
| 資金援助 |  米国, 1件 米国, 1件
| |||||||||
 引用 引用 |  ジャーナル: Nat Commun / 年: 2023 ジャーナル: Nat Commun / 年: 2023タイトル: Structure and regulation of full-length human leucine-rich repeat kinase 1. 著者: Riley D Metcalfe / Juliana A Martinez Fiesco / Luis Bonet-Ponce / Jillian H Kluss / Mark R Cookson / Ping Zhang /  要旨: The human leucine-rich repeat kinases (LRRKs), LRRK1 and LRRK2 are large and unusually complex multi-domain kinases, which regulate fundamental cellular processes and have been implicated in human ...The human leucine-rich repeat kinases (LRRKs), LRRK1 and LRRK2 are large and unusually complex multi-domain kinases, which regulate fundamental cellular processes and have been implicated in human disease. Structures of LRRK2 have recently been determined, but the structure and molecular mechanisms regulating the activity of the LRRK1 as well as differences in the regulation of LRRK1 and LRRK2 remain unclear. Here, we report a cryo-EM structure of the LRRK1 monomer and a lower-resolution cryo-EM map of the LRRK1 dimer. The monomer structure, in which the kinase is in an inactive conformation, reveals key interdomain interfaces that control kinase activity as we validate experimentally. Both the LRRK1 monomer and dimer are structurally distinct compared to LRRK2. Overall, our results provide structural insights into the activation of the human LRRKs, which advance our understanding of their physiological and pathological roles. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_28950.map.gz emd_28950.map.gz | 277.6 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-28950-v30.xml emd-28950-v30.xml emd-28950.xml emd-28950.xml | 13 KB 13 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  emd_28950.png emd_28950.png | 99.7 KB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-28950 http://ftp.pdbj.org/pub/emdb/structures/EMD-28950 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-28950 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-28950 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_28950.map.gz / 形式: CCP4 / 大きさ: 307.5 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_28950.map.gz / 形式: CCP4 / 大きさ: 307.5 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Composite map used for refinement | ||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 0.81 Å | ||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
- 試料の構成要素
試料の構成要素
-全体 : Leucine-rich repeat kinase 1
| 全体 | 名称: Leucine-rich repeat kinase 1 |
|---|---|
| 要素 |
|
-超分子 #1: Leucine-rich repeat kinase 1
| 超分子 | 名称: Leucine-rich repeat kinase 1 / タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: #1 |
|---|---|
| 由来(天然) | 生物種:   Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 230 KDa |
-分子 #1: Leucine-rich repeat serine/threonine-protein kinase 1
| 分子 | 名称: Leucine-rich repeat serine/threonine-protein kinase 1 タイプ: protein_or_peptide / ID: 1 / コピー数: 1 / 光学異性体: LEVO / EC番号:  non-specific serine/threonine protein kinase non-specific serine/threonine protein kinase |
|---|---|
| 由来(天然) | 生物種:   Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 229.556359 KDa |
| 組換発現 | 生物種:   Spodoptera frugiperda (ツマジロクサヨトウ) Spodoptera frugiperda (ツマジロクサヨトウ) |
| 配列 | 文字列: MDYKDHDGDY KDHDIDYKDD DDKLGLEVLF QGPMAGMSQR PPSMYWCVGP EESAVCPERA METLNGAGDT GGKPSTRGGD PAARSRRTE GIRAAYRRGD RGGARDLLEE ACDQCASQLE KGQLLSIPAA YGDLEMVRYL LSKRLVELPT EPTDDNPAVV A AYFGHTAV ...文字列: MDYKDHDGDY KDHDIDYKDD DDKLGLEVLF QGPMAGMSQR PPSMYWCVGP EESAVCPERA METLNGAGDT GGKPSTRGGD PAARSRRTE GIRAAYRRGD RGGARDLLEE ACDQCASQLE KGQLLSIPAA YGDLEMVRYL LSKRLVELPT EPTDDNPAVV A AYFGHTAV VQELLESLPG PCSPQRLLNW MLALACQRGH LGVVKLLVLT HGADPESYAV RKNEFPVIVR LPLYAAIKSG NE DIAIFLL RHGAYFCSYI LLDSPDPSKH LLRKYFIEAS PLPSSYPGKT ALRVKWSHLR LPWVDLDWLI DISCQITELD LSA NCLATL PSVIPWGLIN LRKLNLSDNH LGELPGVQSS DEIICSRLLE IDISSNKLSH LPPGFLHLSK LQKLTASKNC LEKL FEEEN ATNWIGLRKL QELDISDNKL TELPALFLHS FKSLNSLNVS RNNLKVFPDP WACPLKCCKA SRNALECLPD KMAVF WKNH LKDVDFSENA LKEVPLGLFQ LDALMFLRLQ GNQLAALPPQ EKWTCRQLKT LDLSRNQLGK NEDGLKTKRI AFFTTR GRQ RSGTEAASVL EFPAFLSESL EVLCLNDNHL DTVPPSVCLL KSLSELYLGN NPGLRELPPE LGQLGNLWQL DTEDLTI SN VPAEIQKEGP KAMLSYLRAQ LRKAEKCKLM KMIIVGPPRQ GKSTLLEILQ TGRAPQVVHG EATIRTTKWE LQRPAGSR A KVESVEFNVW DIGGPASMAT VNQCFFTDKA LYVVVWNLAL GEEAVANLQF WLLNIEAKAP NAVVLVVGTH LDLIEAKFR VERIATLRAY VLALCRSPSG SRATGFPDIT FKHLHEISCK SLEGQEGLRQ LIFHVTCSMK DVGSTIGCQR LAGRLIPRSY LSLQEAVLA EQQRRSRDDD VQYLTDRQLE QLVEQTPDND IKDYEDLQSA ISFLIETGTL LHFPDTSHGL RNLYFLDPIW L SECLQRIF NIKGSRSVAK NGVIRAEDLR MLLVGTGFTQ QTEEQYFQFL AKFEIALPVA NDSYLLPHLL PSKPGLDTHG MR HPTANTI QRVFKMSFVP VGFWQRFIAR MLISLAEMDL QLFENKKNTK SRNRKVTIYS FTGNQRNRCS TFRVKRNQTI YWQ EGLLVT FDGGYLSVES SDVNWKKKKS GGMKIVCQSE VRDFSAMAFI TDHVNSLIDQ WFPALTATES DGTPLMEQYV PCPV CETAW AQHTDPSEKS EDVQYFDMED CVLTAIERDF ISCPRHPDLP VPLQELVPEL FMTDFPARLF LENSKLEHSE DEGSV LGQG GSGTVIYRAR YQGQPVAVKR FHIKKFKNFA NVPADTMLRH LRATDAMKNF SEFRQEASML HALQHPCIVA LIGISI HPL CFALELAPLS SLNTVLSENA RDSSFIPLGH MLTQKIAYQI ASGLAYLHKK NIIFCDLKSD NILVWSLDVK EHINIKL SD YGISRQSFHE GALGVEGTPG YQAPEIRPRI VYDEKVDMFS YGMVLYELLS GQRPALGHHQ LQIAKKLSKG IRPVLGQP E EVQFRRLQAL MMECWDTKPE KRPLALSVVS QMKDPTFATF MYELCCGKQT AFFSSQGQEY TVVFWDGKEE SRNYTVVNT EKGLMEVQRM CCPGMKVSCQ LQVQRSLWTA TEDQKIYIYT LKGMCPLNTP QQALDTPAVV TCFLAVPVIK KNSYLVLAGL ADGLVAVFP VVRGTPKDSC SYLCSHTANR SKFSIADEDA RQNPYPVKAM EVVNSGSEVW YSNGPGLLVI DCASLEICRR L EPYMAPSM VTSVVCSSEG RGEEVVWCLD DKANSLVMYH STTYQLCARY FCGVPSPLRD MFPVRPLDTE PPAASHTANP KV PEGDSIA DVSIMYSEEL GTQILIHQES LTDYCSMSSY SSSPPRQAAR SPSSLPSSPA SSSSVPFSTD CEDSDMLHTP GAA SDRSEH DLTPMDGETF SQHLQAVKIL AVRDLIWVPR RGGDVIVIGL EKDSGAQRGR VIAVLKAREL TPHGVLVDAA VVAK DTVVC TFENENTEWC LAVWRGWGAR EFDIFYQSYE ELGRLEACTR KRR UniProtKB: Leucine-rich repeat serine/threonine-protein kinase 1 |
-分子 #2: GUANOSINE-5'-DIPHOSPHATE
| 分子 | 名称: GUANOSINE-5'-DIPHOSPHATE / タイプ: ligand / ID: 2 / コピー数: 1 / 式: GDP |
|---|---|
| 分子量 | 理論値: 443.201 Da |
| Chemical component information |  ChemComp-GDP: |
-実験情報
-構造解析
| 手法 |  クライオ電子顕微鏡法 クライオ電子顕微鏡法 |
|---|---|
 解析 解析 |  単粒子再構成法 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 0.2 mg/mL |
|---|---|
| 緩衝液 | pH: 8.3 |
| 凍結 | 凍結剤: ETHANE / 装置: LEICA EM GP |
| 詳細 | Purified LRRK1 |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TALOS ARCTICA |
|---|---|
| 電子線 | 加速電圧: 200 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD Bright-field microscopy / 最大 デフォーカス(公称値): 2.5 µm / 最小 デフォーカス(公称値): 0.8 µm Bright-field microscopy / 最大 デフォーカス(公称値): 2.5 µm / 最小 デフォーカス(公称値): 0.8 µm |
| 撮影 | フィルム・検出器のモデル: GATAN K3 (6k x 4k) / 撮影したグリッド数: 7 / 実像数: 18074 / 平均露光時間: 2.5 sec. / 平均電子線量: 50.0 e/Å2 |
| 実験機器 |  モデル: Talos Arctica / 画像提供: FEI Company |
- 画像解析
画像解析
| 粒子像選択 | 選択した数: 3553719 詳細: Particles picked using a Topaz model trained on an initial LRRK1 dataset. |
|---|---|
| 初期モデル | モデルのタイプ: NONE / 詳細: Ab-initio model generated using Cryosparc. |
| 初期 角度割当 | タイプ: MAXIMUM LIKELIHOOD |
| 最終 角度割当 | タイプ: MAXIMUM LIKELIHOOD |
| 最終 再構成 | 解像度のタイプ: BY AUTHOR / 解像度: 3.92 Å / 解像度の算出法: FSC 0.143 CUT-OFF 詳細: Resolution given for map is the resolution of the global refinement map (D_1000269296). The resolution for the local refinement map was 3.94 (D_1000269298). 使用した粒子像数: 183273 |
 ムービー
ムービー コントローラー
コントローラー