+検索条件
-Structure paper
| タイトル | Structural basis of lipopolysaccharide extraction by the LptBFGC complex. |
|---|---|
| ジャーナル・号・ページ | Nature, Vol. 567, Issue 7749, Page 486-490, Year 2019 |
| 掲載日 | 2019年3月20日 |
 著者 著者 | Yanyan Li / Benjamin J Orlando / Maofu Liao /  |
| PubMed 要旨 | In Gram-negative bacteria, lipopolysaccharide is essential for outer membrane formation and antibiotic resistance. The seven lipopolysaccharide transport (Lpt) proteins A-G move lipopolysaccharide ...In Gram-negative bacteria, lipopolysaccharide is essential for outer membrane formation and antibiotic resistance. The seven lipopolysaccharide transport (Lpt) proteins A-G move lipopolysaccharide from the inner to the outer membrane. The ATP-binding cassette transporter LptBFG, which tightly associates with LptC, extracts lipopolysaccharide out of the inner membrane. The mechanism of the LptBFG-LptC complex (LptBFGC) and the role of LptC in lipopolysaccharide transport are poorly understood. Here we characterize the structures of LptBFG and LptBFGC in nucleotide-free and vanadate-trapped states, using single-particle cryo-electron microscopy. These structures resolve the bound lipopolysaccharide, reveal transporter-lipopolysaccharide interactions with side-chain details and uncover how the capture and extrusion of lipopolysaccharide are coupled to conformational rearrangements of LptBFGC. LptC inserts its transmembrane helix between the two transmembrane domains of LptBFG, which represents a previously unknown regulatory mechanism for ATP-binding cassette transporters. Our results suggest a role for LptC in achieving efficient lipopolysaccharide transport, by coordinating the action of LptBFG in the inner membrane and Lpt protein interactions in the periplasm. |
 リンク リンク |  Nature / Nature /  PubMed:30894744 / PubMed:30894744 /  PubMed Central PubMed Central |
| 手法 | EM (単粒子) |
| 解像度 | 4.0 - 5.9 Å |
| 構造データ | EMDB-9118, PDB-6mhu: EMDB-9124, PDB-6mhz:  EMDB-9128:  EMDB-9129:  EMDB-9130: |
| 化合物 |  ChemComp-JSG: 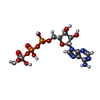 ChemComp-AOV:  ChemComp-PGT: |
| 由来 |
|
 キーワード キーワード | TRANSPORT PROTEIN/Hydrolase /  ABC transporter / ABC transporter /  lipopolysaccharide (リポ多糖) / LPS / lipopolysaccharide (リポ多糖) / LPS /  nanodisc / TRANSPORT PROTEIN-Hydrolase complex / HYDROLASE/TRANSPORT PROTEIN / nanodisc / TRANSPORT PROTEIN-Hydrolase complex / HYDROLASE/TRANSPORT PROTEIN /  MEMBRANE PROTEIN (膜タンパク質) / HYDROLASE-TRANSPORT PROTEIN complex MEMBRANE PROTEIN (膜タンパク質) / HYDROLASE-TRANSPORT PROTEIN complex |
 ムービー
ムービー コントローラー
コントローラー 構造ビューア
構造ビューア 万見文献について
万見文献について












