+検索条件
-Structure paper
| タイトル | Cryo-EM structures of Uba7 reveal the molecular basis for ISG15 activation and E1-E2 thioester transfer. |
|---|---|
| ジャーナル・号・ページ | Nat Commun, Vol. 14, Issue 1, Page 4786, Year 2023 |
| 掲載日 | 2023年8月8日 |
 著者 著者 | Mohammad Afsar / GuanQun Liu / Lijia Jia / Eliza A Ruben / Digant Nayak / Zuberwasim Sayyad / Priscila Dos Santos Bury / Kristin E Cano / Anindita Nayak / Xiang Ru Zhao / Ankita Shukla / Patrick Sung / Elizabeth V Wasmuth / Michaela U Gack / Shaun K Olsen /  |
| PubMed 要旨 | ISG15 plays a crucial role in the innate immune response and has been well-studied due to its antiviral activity and regulation of signal transduction, apoptosis, and autophagy. ISG15 is a ubiquitin- ...ISG15 plays a crucial role in the innate immune response and has been well-studied due to its antiviral activity and regulation of signal transduction, apoptosis, and autophagy. ISG15 is a ubiquitin-like protein that is activated by an E1 enzyme (Uba7) and transferred to a cognate E2 enzyme (UBE2L6) to form a UBE2L6-ISG15 intermediate that functions with E3 ligases that catalyze conjugation of ISG15 to target proteins. Despite its biological importance, the molecular basis by which Uba7 catalyzes ISG15 activation and transfer to UBE2L6 is unknown as there is no available structure of Uba7. Here, we present cryo-EM structures of human Uba7 in complex with UBE2L6, ISG15 adenylate, and ISG15 thioester intermediate that are poised for catalysis of Uba7-UBE2L6-ISG15 thioester transfer. Our structures reveal a unique overall architecture of the complex compared to structures from the ubiquitin conjugation pathway, particularly with respect to the location of ISG15 thioester intermediate. Our structures also illuminate the molecular basis for Uba7 activities and for its exquisite specificity for ISG15 and UBE2L6. Altogether, our structural, biochemical, and human cell-based data provide significant insights into the functions of Uba7, UBE2L6, and ISG15 in cells. |
 リンク リンク |  Nat Commun / Nat Commun /  PubMed:37553340 / PubMed:37553340 /  PubMed Central PubMed Central |
| 手法 | EM (単粒子) |
| 解像度 | 3.2 - 3.67 Å |
| 構造データ | EMDB-40407, PDB-8se9: EMDB-40408, PDB-8sea: EMDB-40409, PDB-8seb: EMDB-40782, PDB-8sv8:  EMDB-40799: Cryo-EM consensus map of a double loaded human UBA7-UBE2L6-ISG15 thioester mimetic complex |
| 化合物 | 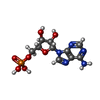 ChemComp-AMP: |
| 由来 |
|
 キーワード キーワード |  LIGASE (リガーゼ) / LIGASE (リガーゼ) /  Signaling Protein / Signaling Protein /  Complex / Complex /  ubiquitin (ユビキチン) ubiquitin (ユビキチン) |
 ムービー
ムービー コントローラー
コントローラー 構造ビューア
構造ビューア 万見文献について
万見文献について












