+検索条件
-Structure paper
| タイトル | Structure and mechanism of the Rubisco-assembly chaperone Raf1. |
|---|---|
| ジャーナル・号・ページ | Nat Struct Mol Biol, Vol. 22, Issue 9, Page 720-728, Year 2015 |
| 掲載日 | 2015年8月3日 |
 著者 著者 | Thomas Hauser / Javaid Y Bhat / Goran Miličić / Petra Wendler / F Ulrich Hartl / Andreas Bracher / Manajit Hayer-Hartl /  |
| PubMed 要旨 | Biogenesis of the photosynthetic enzyme Rubisco, a complex of eight large (RbcL) and eight small (RbcS) subunits, requires assembly chaperones. Here we analyzed the role of Rubisco accumulation ...Biogenesis of the photosynthetic enzyme Rubisco, a complex of eight large (RbcL) and eight small (RbcS) subunits, requires assembly chaperones. Here we analyzed the role of Rubisco accumulation factor1 (Raf1), a dimer of ∼40-kDa subunits. We find that Raf1 from Synechococcus elongatus acts downstream of chaperonin-assisted RbcL folding by stabilizing RbcL antiparallel dimers for assembly into RbcL8 complexes with four Raf1 dimers bound. Raf1 displacement by RbcS results in holoenzyme formation. Crystal structures show that Raf1 from Arabidopsis thaliana consists of a β-sheet dimerization domain and a flexibly linked α-helical domain. Chemical cross-linking and EM reconstruction indicate that the β-domains bind along the equator of each RbcL2 unit, and the α-helical domains embrace the top and bottom edges of RbcL2. Raf1 fulfills a role similar to that of the assembly chaperone RbcX, thus suggesting that functionally redundant factors ensure efficient Rubisco biogenesis. |
 リンク リンク |  Nat Struct Mol Biol / Nat Struct Mol Biol /  PubMed:26237510 PubMed:26237510 |
| 手法 | EM (単粒子) / X線回折 |
| 解像度 | 1.954 - 24.8 Å |
| 構造データ | 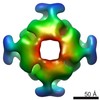 EMDB-3051: 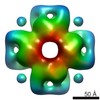 EMDB-3052:  EMDB-3053:  PDB-4wt3:  PDB-4wt4:  PDB-4wt5: |
| 化合物 |  ChemComp-HOH:  ChemComp-PO4: |
| 由来 |
|
 キーワード キーワード |  CHAPERONE (シャペロン) / assembly chaperone CHAPERONE (シャペロン) / assembly chaperone |
 ムービー
ムービー コントローラー
コントローラー 構造ビューア
構造ビューア 万見文献について
万見文献について




 Thermosynechococcus elongatus BP-1 (バクテリア)
Thermosynechococcus elongatus BP-1 (バクテリア)
