+検索条件
-Structure paper
| タイトル | Structure of the DOCK2-ELMO1 complex provides insights into regulation of the auto-inhibited state. |
|---|---|
| ジャーナル・号・ページ | Nat Commun, Vol. 11, Issue 1, Page 3464, Year 2020 |
| 掲載日 | 2020年7月10日 |
 著者 著者 | Leifu Chang / Jing Yang / Chang Hwa Jo / Andreas Boland / Ziguo Zhang / Stephen H McLaughlin / Afnan Abu-Thuraia / Ryan C Killoran / Matthew J Smith / Jean-Francois Côté / David Barford /     |
| PubMed 要旨 | DOCK (dedicator of cytokinesis) proteins are multidomain guanine nucleotide exchange factors (GEFs) for RHO GTPases that regulate intracellular actin dynamics. DOCK proteins share catalytic (DOCK) ...DOCK (dedicator of cytokinesis) proteins are multidomain guanine nucleotide exchange factors (GEFs) for RHO GTPases that regulate intracellular actin dynamics. DOCK proteins share catalytic (DOCK) and membrane-associated (DOCK) domains. The structurally-related DOCK1 and DOCK2 GEFs are specific for RAC, and require ELMO (engulfment and cell motility) proteins for function. The N-terminal RAS-binding domain (RBD) of ELMO (ELMO) interacts with RHOG to modulate DOCK1/2 activity. Here, we determine the cryo-EM structures of DOCK2-ELMO1 alone, and as a ternary complex with RAC1, together with the crystal structure of a RHOG-ELMO2 complex. The binary DOCK2-ELMO1 complex adopts a closed, auto-inhibited conformation. Relief of auto-inhibition to an active, open state, due to a conformational change of the ELMO1 subunit, exposes binding sites for RAC1 on DOCK2, and RHOG and BAI GPCRs on ELMO1. Our structure explains how up-stream effectors, including DOCK2 and ELMO1 phosphorylation, destabilise the auto-inhibited state to promote an active GEF. |
 リンク リンク |  Nat Commun / Nat Commun /  PubMed:32651375 / PubMed:32651375 /  PubMed Central PubMed Central |
| 手法 | EM (単粒子) / X線回折 |
| 解像度 | 2.4 - 5.5 Å |
| 構造データ | EMDB-10497, PDB-6tgb: EMDB-10498: CryoEM structure of the ternary DOCK2-ELMO1-RAC1 complex  PDB-6uka: |
| 化合物 | 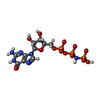 ChemComp-GNP:  ChemComp-MG:  ChemComp-HOH: |
| 由来 |
|
 キーワード キーワード |  SIGNALING PROTEIN / SIGNALING PROTEIN /  guanine nucleotide exchange factor (グアニンヌクレオチド交換因子) / guanine nucleotide exchange factor (グアニンヌクレオチド交換因子) /  cytoskeleton (細胞骨格) / cytoskeleton (細胞骨格) /  actin (アクチン) / actin (アクチン) /  cryoEM (低温電子顕微鏡法) / RHOG / cryoEM (低温電子顕微鏡法) / RHOG /  ELMO / RBD / ELMO / RBD /  complex / complex /  CELL ADHESION (細胞接着) CELL ADHESION (細胞接着) |
 ムービー
ムービー コントローラー
コントローラー 構造ビューア
構造ビューア 万見文献について
万見文献について









