+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-23699 | |||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | High resolution structure of the membrane embedded skeletal muscle ryanodine receptor | |||||||||||||||||||||
 マップデータ マップデータ | ||||||||||||||||||||||
 試料 試料 |
| |||||||||||||||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報ATP-gated ion channel activity / positive regulation of sequestering of calcium ion /  cyclic nucleotide binding / cyclic nucleotide binding /  terminal cisterna / negative regulation of insulin secretion involved in cellular response to glucose stimulus / terminal cisterna / negative regulation of insulin secretion involved in cellular response to glucose stimulus /  ryanodine receptor complex / negative regulation of release of sequestered calcium ion into cytosol / ryanodine-sensitive calcium-release channel activity / neuronal action potential propagation / insulin secretion involved in cellular response to glucose stimulus ...ATP-gated ion channel activity / positive regulation of sequestering of calcium ion / ryanodine receptor complex / negative regulation of release of sequestered calcium ion into cytosol / ryanodine-sensitive calcium-release channel activity / neuronal action potential propagation / insulin secretion involved in cellular response to glucose stimulus ...ATP-gated ion channel activity / positive regulation of sequestering of calcium ion /  cyclic nucleotide binding / cyclic nucleotide binding /  terminal cisterna / negative regulation of insulin secretion involved in cellular response to glucose stimulus / terminal cisterna / negative regulation of insulin secretion involved in cellular response to glucose stimulus /  ryanodine receptor complex / negative regulation of release of sequestered calcium ion into cytosol / ryanodine-sensitive calcium-release channel activity / neuronal action potential propagation / insulin secretion involved in cellular response to glucose stimulus / release of sequestered calcium ion into cytosol by sarcoplasmic reticulum / ossification involved in bone maturation / cell communication by electrical coupling involved in cardiac conduction / response to redox state / protein maturation by protein folding / 'de novo' protein folding / skin development / negative regulation of heart rate / negative regulation of phosphoprotein phosphatase activity / ryanodine receptor complex / negative regulation of release of sequestered calcium ion into cytosol / ryanodine-sensitive calcium-release channel activity / neuronal action potential propagation / insulin secretion involved in cellular response to glucose stimulus / release of sequestered calcium ion into cytosol by sarcoplasmic reticulum / ossification involved in bone maturation / cell communication by electrical coupling involved in cardiac conduction / response to redox state / protein maturation by protein folding / 'de novo' protein folding / skin development / negative regulation of heart rate / negative regulation of phosphoprotein phosphatase activity /  FK506 binding / positive regulation of axon regeneration / cellular response to caffeine / outflow tract morphogenesis / intracellularly gated calcium channel activity / organelle membrane / : / smooth muscle contraction / FK506 binding / positive regulation of axon regeneration / cellular response to caffeine / outflow tract morphogenesis / intracellularly gated calcium channel activity / organelle membrane / : / smooth muscle contraction /  toxic substance binding / toxic substance binding /  小胞体 / negative regulation of ryanodine-sensitive calcium-release channel activity / 小胞体 / negative regulation of ryanodine-sensitive calcium-release channel activity /  voltage-gated calcium channel activity / response to vitamin E / calcium channel inhibitor activity / regulation of cardiac muscle contraction by regulation of the release of sequestered calcium ion / protein peptidyl-prolyl isomerization / skeletal muscle fiber development / T cell proliferation / striated muscle contraction / regulation of release of sequestered calcium ion into cytosol by sarcoplasmic reticulum / release of sequestered calcium ion into cytosol / Ion homeostasis / regulation of ryanodine-sensitive calcium-release channel activity / sarcoplasmic reticulum membrane / voltage-gated calcium channel activity / response to vitamin E / calcium channel inhibitor activity / regulation of cardiac muscle contraction by regulation of the release of sequestered calcium ion / protein peptidyl-prolyl isomerization / skeletal muscle fiber development / T cell proliferation / striated muscle contraction / regulation of release of sequestered calcium ion into cytosol by sarcoplasmic reticulum / release of sequestered calcium ion into cytosol / Ion homeostasis / regulation of ryanodine-sensitive calcium-release channel activity / sarcoplasmic reticulum membrane /  calcium channel complex / regulation of cytosolic calcium ion concentration / cellular response to calcium ion / calcium channel complex / regulation of cytosolic calcium ion concentration / cellular response to calcium ion /  筋小胞体 / 筋小胞体 /  プロリルイソメラーゼ / プロリルイソメラーゼ /  peptidyl-prolyl cis-trans isomerase activity / peptidyl-prolyl cis-trans isomerase activity /  muscle contraction / calcium ion transmembrane transport / muscle contraction / calcium ion transmembrane transport /  calcium channel activity / response to hydrogen peroxide / Stimuli-sensing channels / calcium channel activity / response to hydrogen peroxide / Stimuli-sensing channels /  筋鞘 / Z disc / intracellular calcium ion homeostasis / disordered domain specific binding / positive regulation of cytosolic calcium ion concentration / protein refolding / protein homotetramerization / transmembrane transporter binding / 筋鞘 / Z disc / intracellular calcium ion homeostasis / disordered domain specific binding / positive regulation of cytosolic calcium ion concentration / protein refolding / protein homotetramerization / transmembrane transporter binding /  calmodulin binding / calmodulin binding /  signaling receptor binding / signaling receptor binding /  calcium ion binding / calcium ion binding /  ATP binding / ATP binding /  生体膜 / identical protein binding / 生体膜 / identical protein binding /  細胞質基質 / 細胞質基質 /  細胞質 細胞質類似検索 - 分子機能 | |||||||||||||||||||||
| 生物種 |   Oryctolagus cuniculus (ウサギ) / Oryctolagus cuniculus (ウサギ) /   Homo sapiens (ヒト) / Homo sapiens (ヒト) /   Rabbit (ウサギ) Rabbit (ウサギ) | |||||||||||||||||||||
| 手法 |  単粒子再構成法 / 単粒子再構成法 /  クライオ電子顕微鏡法 / 解像度: 3.98 Å クライオ電子顕微鏡法 / 解像度: 3.98 Å | |||||||||||||||||||||
 データ登録者 データ登録者 | Melville Z / Kim K / Clarke OB / Marks AR | |||||||||||||||||||||
| 資金援助 |  米国, 6件 米国, 6件
| |||||||||||||||||||||
 引用 引用 |  ジャーナル: Structure / 年: 2022 ジャーナル: Structure / 年: 2022タイトル: High-resolution structure of the membrane-embedded skeletal muscle ryanodine receptor. 著者: Zephan Melville / Kookjoo Kim / Oliver B Clarke / Andrew R Marks /  要旨: The type 1 ryanodine receptor (RyR)/calcium release channel on the sarcoplasmic reticulum (SR) is required for skeletal muscle excitation-contraction coupling and is the largest known ion channel, ...The type 1 ryanodine receptor (RyR)/calcium release channel on the sarcoplasmic reticulum (SR) is required for skeletal muscle excitation-contraction coupling and is the largest known ion channel, composed of four 565-kDa protomers. Cryogenic electron microscopy (cryo-EM) studies of the RyR have primarily used detergent to solubilize the channel; in the present study, we have used cryo-EM to solve high-resolution structures of the channel in liposomes using a gel-filtration approach with on-column detergent removal to form liposomes and incorporate the channel simultaneously. This allowed us to resolve the structure of the channel in the primed and open states at 3.4 and 4.0 Å, respectively, with a single dataset. This method offers validation for detergent-based structures of the RyR and offers a starting point for utilizing a chemical gradient mimicking the SR, where Ca concentrations are millimolar in the lumen and nanomolar in the cytosol. | |||||||||||||||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_23699.map.gz emd_23699.map.gz | 452.2 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-23699-v30.xml emd-23699-v30.xml emd-23699.xml emd-23699.xml | 26.8 KB 26.8 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_23699_fsc.xml emd_23699_fsc.xml | 23.5 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_23699.png emd_23699.png | 244.8 KB | ||
| マスクデータ |  emd_23699_msk_1.map emd_23699_msk_1.map | 512 MB |  マスクマップ マスクマップ | |
| その他 |  emd_23699_half_map_1.map.gz emd_23699_half_map_1.map.gz emd_23699_half_map_2.map.gz emd_23699_half_map_2.map.gz | 475.6 MB 475.6 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-23699 http://ftp.pdbj.org/pub/emdb/structures/EMD-23699 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-23699 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-23699 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  7m6lMC  7m6aC C: 同じ文献を引用 ( M: このマップから作成された原子モデル |
|---|---|
| 類似構造データ | |
| 電子顕微鏡画像生データ |  EMPIAR-10793 (タイトル: Cryo-electron microscopy of the liposome-embedded type 1 ryanodine receptor EMPIAR-10793 (タイトル: Cryo-electron microscopy of the liposome-embedded type 1 ryanodine receptorData size: 2.4 TB Data #1: Liposome-embedded type-1 ryanodine receptor [micrographs - multiframe]) |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_23699.map.gz / 形式: CCP4 / 大きさ: 512 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_23699.map.gz / 形式: CCP4 / 大きさ: 512 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ボクセルのサイズ | X=Y=Z: 0.831 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
-マスク #1
| ファイル |  emd_23699_msk_1.map emd_23699_msk_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: #2
| ファイル | emd_23699_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: #1
| ファイル | emd_23699_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : Proteoliposomal ryanodine receptor with calstabin-2 in the open state
| 全体 | 名称: Proteoliposomal ryanodine receptor with calstabin-2 in the open state |
|---|---|
| 要素 |
|
-超分子 #1: Proteoliposomal ryanodine receptor with calstabin-2 in the open state
| 超分子 | 名称: Proteoliposomal ryanodine receptor with calstabin-2 in the open state タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: #1-#2 |
|---|---|
| 由来(天然) | 生物種:   Oryctolagus cuniculus (ウサギ) Oryctolagus cuniculus (ウサギ) |
| 分子量 | 理論値: 2.31 MDa |
-分子 #1: Peptidyl-prolyl cis-trans isomerase FKBP1B
| 分子 | 名称: Peptidyl-prolyl cis-trans isomerase FKBP1B / タイプ: protein_or_peptide / ID: 1 / コピー数: 4 / 光学異性体: LEVO / EC番号:  プロリルイソメラーゼ プロリルイソメラーゼ |
|---|---|
| 由来(天然) | 生物種:   Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 11.798501 KDa |
| 組換発現 | 生物種:   Escherichia coli (大腸菌) Escherichia coli (大腸菌) |
| 配列 | 文字列: MGVEIETISP GDGRTFPKKG QTCVVHYTGM LQNGKKFDSS RDRNKPFKFR IGKQEVIKGF EEGAAQMSLG QRAKLTCTPD VAYGATGHP GVIPPNATLI FDVELLNLE |
-分子 #2: Ryanodine receptor 1
| 分子 | 名称: Ryanodine receptor 1 / タイプ: protein_or_peptide / ID: 2 / コピー数: 4 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:   Rabbit (ウサギ) Rabbit (ウサギ) |
| 分子量 | 理論値: 565.908625 KDa |
| 配列 | 文字列: MGDGGEGEDE VQFLRTDDEV VLQCSATVLK EQLKLCLAAE GFGNRLCFLE PTSNAQNVPP DLAICCFTLE QSLSVRALQE MLANTVEAG VESSQGGGHR TLLYGHAILL RHAHSRMYLS CLTTSRSMTD KLAFDVGLQE DATGEACWWT MHPASKQRSE G EKVRVGDD ...文字列: MGDGGEGEDE VQFLRTDDEV VLQCSATVLK EQLKLCLAAE GFGNRLCFLE PTSNAQNVPP DLAICCFTLE QSLSVRALQE MLANTVEAG VESSQGGGHR TLLYGHAILL RHAHSRMYLS CLTTSRSMTD KLAFDVGLQE DATGEACWWT MHPASKQRSE G EKVRVGDD LILVSVSSER YLHLSTASGE LQVDASFMQT LWNMNPICSC CEEGYVTGGH VLRLFHGHMD ECLTISAADS DD QRRLVYY EGGAVCTHAR SLWRLEPLRI SWSGSHLRWG QPLRIRHVTT GRYLALTEDQ GLVVVDACKA HTKATSFCFR VSK EKLDTA PKRDVEGMGP PEIKYGESLC FVQHVASGLW LTYAAPDPKA LRLGVLKKKA ILHQEGHMDD ALFLTRCQQE ESQA ARMIH STAGLYNQFI KGLDSFSGKP RGSGPPAGPA LPIEAVILSL QDLIGYFEPP SEELQHEEKQ SKLRSLRNRQ SLFQE EGML SLVLNCIDRL NVYTTAAHFA EYAGEEAAES WKEIVNLLYE LLASLIRGNR ANCALFSTNL DWVVSKLDRL EASSGI LEV LYCVLIESPE VLNIIQENHI KSIISLLDKH GRNHKVLDVL CSLCVCNGVA VRSNQDLITE NLLPGRELLL QTNLINY VT SIRPNIFVGR AEGSTQYGKW YFEVMVDEVV PFLTAQATHL RVGWALTEGY SPYPGGGEGW GGNGVGDDLY SYGFDGLH L WTGHVARPVT SPGQHLLAPE DVVSCCLDLS VPSISFRING CPVQGVFEAF NLDGLFFPVV SFSAGVKVRF LLGGRHGEF KFLPPPGYAP CHEAVLPRER LRLEPIKEYR REGPRGPHLV GPSRCLSHTD FVPCPVDTVQ IVLPPHLERI REKLAENIHE LWALTRIEQ GWTYGPVRDD NKRLHPCLVN FHSLPEPERN YNLQMSGETL KTLLALGCHV GMADEKAEDN LKKTKLPKTY M MSNGYKPA PLDLSHVRLT PAQTTLVDRL AENGHNVWAR DRVAQGWSYS AVQDIPARRN PRLVPYRLLD EATKRSNRDS LC QAVRTLL GYGYNIEPPD QEPSQVENQS RWDRVRIFRA EKSYTVQSGR WYFEFEAVTT GEMRVGWARP ELRPDVELGA DEL AYVFNG HRGQRWHLGS EPFGRPWQSG DVVGCMIDLT ENTIIFTLNG EVLMSDSGSE TAFREIEIGD GFLPVCSLGP GQVG HLNLG QDVSSLRFFA ICGLQEGFEP FAINMQRPVT TWFSKSLPQF EPVPPEHPHY EVARMDGTVD TPPCLRLAHR TWGSQ NSLV EMLFLRLSLP VQFHQHFRCT AGATPLAPPG LQPPAEDEAR AAEPDPDYEN LRRSAGGWGE AEGGKEGTAK EGTPGG TPQ PGVEAQPVRA ENEKDATTEK NKKRGFLFKA KKAAMMTQPP ATPALPRLPH DVVPADNRDD PEIILNTTTY YYSVRVF AG QEPSCVWVGW VTPDYHQHDM NFDLSKVRAV TVTMGDEQGN VHSSLKCSNC YMVWGGDFVS PGQQGRISHT DLVIGCLV D LATGLMTFTA NGKESNTFFQ VEPNTKLFPA VFVLPTHQNV IQFELGKQKN IMPLSAAMFL SERKNPAPQC PPRLEVQML MPVSWSRMPN HFLQVETRRA GERLGWAVQC QDPLTMMALH IPEENRCMDI LELSERLDLQ RFHSHTLRLY RAVCALGNNR VAHALCSHV DQAQLLHALE DAHLPGPLRA GYYDLLISIH LESACRSRRS MLSEYIVPLT PETRAITLFP PGRKGGNARR H GLPGVGVT TSLRPPHHFS PPCFVAALPA AGVAEAPARL SPAIPLEALR DKALRMLGEA VRDGGQHARD PVGGSVEFQF VP VLKLVST LLVMGIFGDE DVKQILKMIE PEVFTEEEEE EEEEEEEEEE EEEDEEEKEE DEEEEEKEDA EKEEEEAPEG EKE DLEEGL LQMKLPESVK LQMCNLLEYF CDQELQHRVE SLAAFAERYV DKLQANQRSR YALLMRAFTM SAAETARRTR EFRS PPQEQ INMLLHFKDE ADEEDCPLPE DIRQDLQDFH QDLLAHCGIQ LEGEEEEPEE ETSLSSRLRS LLETVRLVKK KEEKP EEEL PAEEKKPQSL QELVSHMVVR WAQEDYVQSP ELVRAMFSLL HRQYDGLGEL LRALPRAYTI SPSSVEDTMS LLECLG QIR SLLIVQMGPQ EENLMIQSIG NIMNNKVFYQ HPNLMRALGM HETVMEVMVN VLGGGETKEI RFPKMVTSCC RFLCYFC RI SRQNQRSMFD HLSYLLENSG IGLGMQGSTP LDVAAASVID NNELALALQE QDLEKVVSYL AGCGLQSCPM LLAKGYPD I GWNPCGGERY LDFLRFAVFV NGESVEENAN VVVRLLIRKP ECFGPALRGE GGSGLLAAIE EAIRISEDPA RDGPGVRRD RRREHFGEEP PEENRVHLGH AIMSFYAALI DLLGRCAPEM HLIQAGKGEA LRIRAILRSL VPLDDLVGII SLPLQIPTLG KDGALVQPK MSASFVPDHK ASMVLFLDRV YGIENQDFLL HVLDVGFLPD MRAAASLDTA TFSTTEMALA LNRYLCLAVL P LITKCAPL FAGTEHRAIM VDSMLHTVYR LSRGRSLTKA QRDVIEDCLM ALCRYIRPSM LQHLLRRLVF DVPILNEFAK MP LKLLTNH YERCWKYYCL PTGWANFGVT SEEELHLTRK LFWGIFDSLA HKKYDQELYR MAMPCLCAIA GALPPDYVDA SYS SKAEKK ATVDAEGNFD PRPVETLNVI IPEKLDSFIN KFAEYTHEKW AFDKIQNNWS YGENVDEELK THPMLRPYKT FSEK DKEIY RWPIKESLKA MIAWEWTIEK AREGEEERTE KKKTRKISQT AQTYDPREGY NPQPPDLSGV TLSRELQAMA EQLAE NYHN TWGRKKKQEL EAKGGGTHPL LVPYDTLTAK EKARDREKAQ ELLKFLQMNG YAVTRGLKDM ELDTSSIEKR FAFGFL QQL LRWMDISQEF IAHLEAVVSS GRVEKSPHEQ EIKFFAKILL PLINQYFTNH CLYFLSTPAK VLGSGGHASN KEKEMIT SL FCKLAALVRH RVSLFGTDAP AVVNCLHILA RSLDARTVMK SGPEIVKAGL RSFFESASED IEKMVENLRL GKVSQART Q VKGVGQNLTY TTVALLPVLT TLFQHIAQHQ FGDDVILDDV QVSCYRTLCS IYSLGTTKNT YVEKLRPALG ECLARLAAA MPVAFLEPQL NEYNACSVYT TKSPRERAIL GLPNSVEEMC PDIPVLDRLM ADIGGLAESG ARYTEMPHVI EITLPMLCSY LPRWWERGP EAPPPALPAG APPPCTAVTS DHLNSLLGNI LRIIVNNLGI DEATWMKRLA VFAQPIVSRA RPELLHSHFI P TIGRLRKR AGKVVAEEEQ LRLEAKAEAE EGELLVRDEF SVLCRDLYAL YPLLIRYVDN NRAHWLTEPN ANAEELFRMV GE IFIYWSK SHNFKREEQN FVVQNEINNM SFLTADSKSK MAKAGDAQSG GSDQERTKKK RRGDRYSVQT SLIVATLKKM LPI GLNMCA PTDQDLIMLA KTRYALKDTD EEVREFLQNN LHLQGKVEGS PSLRWQMALY RGLPGREEDA DDPEKIVRRV QEVS AVLYH LEQTEHPYKS KKAVWHKLLS KQRRRAVVAC FRMTPLYNLP THRACNMFLE SYKAAWILTE DHSFEDRMID DLSKA GEQE EEEEEVEEKK PDPLHQLVLH FSRTALTEKS KLDEDYLYMA YADIMAKSCH LEEGGENGEA EEEEVEVSFE EKEMEK QRL LYQQSRLHTR GAAEMVLQMI SACKGETGAM VSSTLKLGIS ILNGGNAEVQ QKMLDYLKDK KEVGFFQSIQ ALMQTCS VL DLNAFERQNK AEGLGMVNED GTVINRQNGE KVMADDEFTQ DLFRFLQLLC EGHNNDFQNY LRTQTGNTTT INIIICTV D YLLRLQESIS DFYWYYSGKD VIEEQGKRNF SKAMSVAKQV FNSLTEYIQG PCTGNQQSLA HSRLWDAVVG FLHVFAHMM MKLAQDSSQI ELLKELLDLQ KDMVVMLLSL LEGNVVNGMI ARQMVDMLVE SSSNVEMILK FFDMFLKLKD IVGSEAFQDY VTDPRGLIS KKDFQKAMDS QKQFTGPEIQ FLLSCSEADE NEMINFEEFA NRFQEPARDI GFNVAVLLTN LSEHVPHDPR L RNFLELAE SILEYFRPYL GRIEIMGASR RIERIYFEIS ETNRAQWEMP QVKESKRQFI FDVVNEGGEA EKMELFVSFC ED TIFEMQI AAQISEPEGE PEADEDEGMG EAAAEGAEEG AAGAEGAAGT VAAGATARLA AAAARALRGL SYRSLRRRVR RLR RLTARE AATALAALLW AVVARAGAAG AGAAAGALRL LWGSLFGGGL VEGAKKVTVT ELLAGMPDPT SDEVHGEQPA GPGG DADGA GEGEGEGDAA EGDGDEEVAG HEAGPGGAEG VVAVADGGPF RPEGAGGLGD MGDTTPAEPP TPEGSPILKR KLGVD GEEE ELVPEPEPEP EPEPEKADEE NGEKEEVPEA PPEPPKKAPP SPPAKKEEAG GAGMEFWGEL EVQRVKFLNY LSRNFY TLR FLALFLAFAI NFILLFYKVS DSPPGEDDME GSAAGDLAGA GSGGGSGWGS GAGEEAEGDE DENMVYYFLE ESTGYME PA LWCLSLLHTL VAFLCIIGYN CLKVPLVIFK REKELARKLE FDGLYITEQP GDDDVKGQWD RLVLNTPSFP SNYWDKFV K RKVLDKHGDI FGRERIAELL GMDLASLEIT AHNERKPDPP PGLLTWLMSI DVKYQIWKFG VIFTDNSFLY LGWYMVMSL LGHYNNFFFA AHLLDIAMGV KTLRTILSSV THNGKQLVMT VGLLAVVVYL YTVVAFNFFR KFYNKSEDED EPDMKCDDMM TCYLFHMYV GVRAGGGIGD EIEDPAGDEY ELYRVVFDIT FFFFVIVILL AIIQGLIIDA FGELRDQQEQ VKEDMETKCF I CGIGSDYF DTTPHGFETH TLEEHNLANY MFFLMYLINK DETEHTGQES YVWKMYQERC WDFFPAGDCF RKQYEDQLS |
-分子 #3: ADENOSINE-5'-TRIPHOSPHATE
| 分子 | 名称: ADENOSINE-5'-TRIPHOSPHATE / タイプ: ligand / ID: 3 / コピー数: 4 / 式: ATP |
|---|---|
| 分子量 | 理論値: 507.181 Da |
| Chemical component information |  ChemComp-ATP: |
-分子 #4: CALCIUM ION
| 分子 | 名称: CALCIUM ION / タイプ: ligand / ID: 4 / コピー数: 4 / 式: CA |
|---|---|
| 分子量 | 理論値: 40.078 Da |
-分子 #5: ZINC ION
| 分子 | 名称: ZINC ION / タイプ: ligand / ID: 5 / コピー数: 4 / 式: ZN |
|---|---|
| 分子量 | 理論値: 65.409 Da |
-分子 #6: CAFFEINE
| 分子 | 名称: CAFFEINE / タイプ: ligand / ID: 6 / コピー数: 4 / 式: CFF |
|---|---|
| 分子量 | 理論値: 194.191 Da |
| Chemical component information | 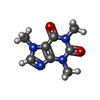 ChemComp-CFF: |
-実験情報
-構造解析
| 手法 |  クライオ電子顕微鏡法 クライオ電子顕微鏡法 |
|---|---|
 解析 解析 |  単粒子再構成法 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 3 mg/mL | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| 緩衝液 | pH: 7.5 構成要素:
| ||||||||||
| 糖包埋 | 材質: Lipid / 詳細: Embedded in liposomes | ||||||||||
| グリッド | モデル: Quantifoil R0.6/1 / 材質: GOLD / メッシュ: 300 / 支持フィルム - 材質: GOLD / 支持フィルム - トポロジー: HOLEY / 前処理 - タイプ: PLASMA CLEANING | ||||||||||
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 100 % / チャンバー内温度: 277.15 K / 装置: FEI VITROBOT MARK IV |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD Bright-field microscopy / Cs: 2.7 mm / 最大 デフォーカス(公称値): 2.0 µm / 最小 デフォーカス(公称値): 1.0 µm / 倍率(公称値): 105000 Bright-field microscopy / Cs: 2.7 mm / 最大 デフォーカス(公称値): 2.0 µm / 最小 デフォーカス(公称値): 1.0 µm / 倍率(公称値): 105000 |
| 試料ステージ | 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER ホルダー冷却材: NITROGEN |
| 撮影 | フィルム・検出器のモデル: GATAN K3 BIOQUANTUM (6k x 4k) 撮影したグリッド数: 1 / 実像数: 11187 / 平均露光時間: 2.5 sec. / 平均電子線量: 58.34 e/Å2 |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
- 画像解析
画像解析
-原子モデル構築 1
| 精密化 | プロトコル: AB INITIO MODEL |
|---|---|
| 得られたモデル |  PDB-7m6l: |
 ムービー
ムービー コントローラー
コントローラー




















 Z
Z Y
Y X
X


























